
| A. | 同一主族元素的原子序数的差不可能为10 | |
| B. | 同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1 | |
| C. | 催化剂一般在金属与非金属的分界线处寻找 | |
| D. | 过渡元素全部是金属元素 |
分析 A.H与Na处于同一主族,二者的原子序数差为10;
B.根据周期表中第ⅡA族与第ⅢA族元素的位置分析;
C.催化剂一般在过渡元素处寻找;
D.过渡元素包含副族和第VIII族.
解答 解:A.H的原子序数为1,Na的原子序数为11,则H与Na的原子序数差为10,故A错误;
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值是1或11或25,不一定是1,故B错误;
C.催化剂一般在过渡元素处寻找,一般在金属与非金属的分界线处寻找半导体材料,故C错误;
D.过渡元素包含副族和第VIII族,过渡元素全部是金属元素,故D正确;
故选A.
点评 本题考查元素周期表结构及其应用,题目难度不大,注意掌握元素周期律的理解掌握,能够识记周期表中一些特殊性,试题侧重基础知识的考查,培养了学生的灵活应用能力.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:选择题
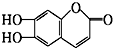 ,下列叙述不正确的是( )
,下列叙述不正确的是( )| A. | M的相对分子质量是178 | |
| B. | 1mol M最多能与2 mol Br2发生反应 | |
| C. | M与足量的NaOH溶液发生反应时,所得有机产物的分子式为C9H4O5Na4 | |
| D. | 1mol M与足量碳酸氢钠反应能生成2mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO溶于氢碘酸溶液中:MgO+2H+═Mg2++H2O | |
| B. | S与NaOH溶液加热时反应与Cl2相似,其离子方程式为:3S+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$2S2-+SO32-+3H2O | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | FeSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③⑥ | C. | ③④⑤⑥ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA的物质的量浓度(mol•L-1) | NaOH的物质的量浓度(mol•L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=5的NaHSO3溶液中:c(HSO3-)>c(SO32-)>c(H2SO3) | |
| B. | 同浓度的下列溶液中,①NH4HSO4 ②NH4Cl ③NH3•H2O c(NH4+)由大到小的顺序是:②>①>③ | |
| C. | 0.2 mol/L CH3COOH溶液和0.2 mol/L CH3COONa溶液等体积混合(忽略混合时体积变化):c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与W可以形成W2X、W2X2两种化合物 | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | X、Y、Z对应氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y、Z两元素的简单离子的半径Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
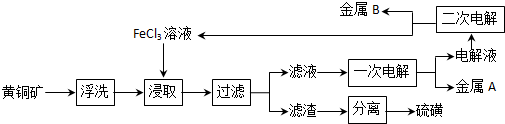
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com