
分析 根据反应后溶液中氢离子浓度计算剩余硫酸的物质的量,假定气体A全部为二氧化硫,根据硫原子守恒计算二氧化硫的物质的量,与实际气体的物质的量比较判断气体的成分,据此解答.
解答 解:反应后测得溶液c(H+)为0.1mol/L,则n剩余(H2SO4)=0.1mol/L×1L×$\frac{1}{2}$=0.05mol,假定气体A全部为二氧化硫,根据硫原子守恒和反应方程式可知,生成二氧化硫的物质的量=(18.5mol/L×0.1L-0.05mol)×$\frac{1}{2}$=0.9mol,实际气体A的物质的量=$\frac{3.36L}{22.4L/mol}$=1.5mol,大于0.9mol,故生成气体为SO2、H2,
令SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4=ZnSO4+SO2↑+H2O,
2xmol xmol
Zn+H2SO4=ZnSO4+H2↑,
ymol ymol
故:x+y=1.5,2x+y=1.8,联立方程,解得:x=0.3,y=1.2
x:y=0.3mol:1.2mol=1:4,
故答案为:SO2;H2;1:4.
点评 本题考查根据方程式的有关计算,难度中等,判断气体的成分是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: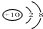 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: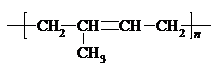 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离出来的c(H+ )=l.0xl0-12 mol/L | |
| B. | c (CH3COOH)>c (H+ )>c (CH3COO- )>c (OH-) | |
| C. | 与同浓度的盐酸分别加水稀释10倍:pH (醋酸)<pH (盐酸) | |
| D. | 与等体积的氢氧化钠溶液反应:c (CH3COOH)+c (CH3COO- )=0.01mol/L. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在NO2气体中的NO:将气体与过量O2混合 | |
| B. | 除去混在CO2气体中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量的BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:相混合液中加入生石灰后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
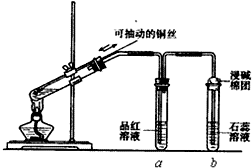 某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.
某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含氧原子个数比为2:3 | B. | 含硫元素质量比为1:1 | ||
| C. | 含氧元素质量比为5:6 | D. | 含硫原子个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com