
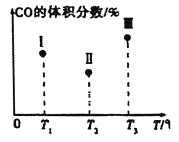
【题目】一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁,其反应:Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ΔH,在容积固定且均为1L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入1molCO和2molH2,三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到t min时CO的体积分数如图所示。下列说法正确的是( )
A.该反应的ΔH>0
B.容器Ⅲ中CO的体积分数可能为35%
C.容器中固体的质量不再改变,不能说明反应已达平衡状态
D.反应进行到tmin时,三个容器中一定达到平衡状态的是Ⅱ和Ⅲ
【答案】A
【解析】
在容积均为1L的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”的金属铁,然后分别充入1molCO和2molH2,发生反应Fe2O3(s)+3CH4(g)2Fe(s)+3CO(g)+6H2(g) ![]() ,根据图中Ⅰ、Ⅱ、ⅢCO的体积分数由小到大依次为:Ⅱ
,根据图中Ⅰ、Ⅱ、ⅢCO的体积分数由小到大依次为:Ⅱ![]() Ⅰ
Ⅰ![]() Ⅲ,
Ⅲ,![]() 中的状态转变成
中的状态转变成![]() 中的状态,CO百分含量减小,说明反应逆向进行,说明
中的状态,CO百分含量减小,说明反应逆向进行,说明![]() 未达平衡状态,
未达平衡状态,![]() 中的状态转变成
中的状态转变成![]() 中的状态,CO百分含量增大,说明反应正向进行,说明
中的状态,CO百分含量增大,说明反应正向进行,说明![]() 可能达平衡状态,一定达到化学平衡状态的是Ⅲ,且该反应正反应为吸热反应,即
可能达平衡状态,一定达到化学平衡状态的是Ⅲ,且该反应正反应为吸热反应,即![]() ,以此解答。
,以此解答。
A.该反应的![]() ,故 A正确;
,故 A正确;
B.假如容器Ⅲ中CO的体积分数为![]() ,根据
,根据
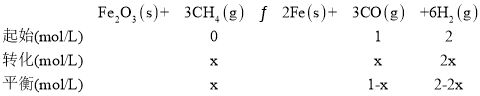
则![]() ,
,![]() ,故B错误;
,故B错误;
C.反应物和生成物都有固体,当容器中固体的质量不再改变,能说明反应已达平衡状态,故C错误;
D.根据以上分析,反应进行到![]() 时,三个容器中一定达到平衡状态的是Ⅲ ,故D错误。
时,三个容器中一定达到平衡状态的是Ⅲ ,故D错误。
故选:A。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:Zn(s) +![]() O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
O2(g) =ZnO(s) ΔH1=-351.1kJ/mol
Hg(l) +![]() O2(g) = HgO(s) ΔH2=-90.7kJ/mol
O2(g) = HgO(s) ΔH2=-90.7kJ/mol
由此可知Zn(s) + HgO(s) = ZnO(s) + Hg(l)的ΔH3,其中ΔH3的值是
A.-260.4 kJ/molB.-254.6 kJ/molC.-438.9 kJ/molD.-441.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.在合成氨的反应中,加压有利于氨的合成
D.Fe(SCN)3溶液中加入NaOH后溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论均正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 取少量Na2SO3固体于试管中,加水溶解,滴加Ba(NO3)2溶液,再滴加稀硝酸 | 滴加Ba(NO3)2溶液,产生白色沉淀,再滴加稀硝酸,沉淀不溶解 | Na2SO3固体已经变质 |
B | 将SO2通入酸性KMnO4溶液中 | 溶液的紫红色褪去 | SO2具有漂白性 |
C | 将铁片投入浓硫酸中 | 无明显变化 | 常温下铁不与浓硫酸反应 |
D | 将10mL2mol/L的KI溶液与1mL1mol/LFeCl3溶液混合充分反应后滴加KSCN溶液 | 溶液颜色变红 | KI与FeCl3的反应具有可逆性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B. 一定条件下,将0.5 molN2和1.5molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=﹣38.6kJ/mol
2NH3(g)△H=﹣38.6kJ/mol
C. 已知2C(s)+2O2(g) ═2CO2(g);△H1;2C(s)+O2(g)=2CO(g) △H2 则△H1>△H2
D. 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同条件下进行合成氨的反应N2(g)+3H2(g) ![]() 2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
2NH3(l),根据下列在相同时间内测定的结果判断生成氨的速率最快的是( )
A.v(H2)=0.1mol/(L·min)B.v(N2)=0.1mol/(L·min)
C.v(N2)=0.2mol/(L·min)D.v(NH3)=0.3mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各情况,在其中Fe片腐蚀由快到慢的顺序是( )
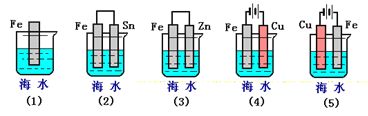
A. (5)(2)(1)(3)(4) B. (2)(5)(3)(4)(1)
C. (5)(3)(4)(1)(2) D. (1)(5)(3)(4)(2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙胺(CH3-CH2-NH2)极易挥发,溶于水、乙醇、乙醚等,可用于生产染料、医药和离子交换树脂等。将乙醇与氨气置于温度为350~400℃、压强为2.45~2.94MPa和催化剂为氧化铝的条件下反应可制备乙胺。

Ⅰ.氨气的制备
(1)用如图所示装置制备NH3。
①仪器A的名称是___。
②试剂X可能是CaO或__(填试剂名称),若选择CaO时,能产生NH3的原因是___。
Ⅱ.乙胺的制备与提纯
(2)乙胺的制备:
生成乙胺(CH3CH2-NH2)的化学方程式为___。(可不写反应条件)
(3)已知:制备过程中除了生成乙胺外,还会产生二乙胺、三乙胺、乙醚、乙氰和乙烯。

用如图装置提纯乙胺:

①提纯乙胺装置中的一处错误是___。
②冷凝管的冷水(10℃)由___(填“M”或“N”)口流出。
③错误纠正后蒸馏,收集___℃左右的馏分。
④冰水浴的作用是___。
(4)乙醇的密度为0.8g·cm-3,若取230.00mL无水乙醇,与过量氨气反应后,经提纯后得到142.02g乙胺,则乙胺的产率为__%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com