
2013��1��13���й�Ӧ�ü��������������ñ��Ʊ�ż��Ⱦ�Ϻ�ҽҩ�м���ķ������������Ʊ�ż��Ⱦ��F��ҽҩ�м���Y������ͼ���£�


�ش��������⣺
(1)���ĺ˴Ź�����������________�壬��Ӧ�ٵķ�Ӧ����____________��
(2)д��D��E��Ӧ�Ļ�ѧ����ʽ______________________��
(3)д��������A��F�Ľṹ��ʽ��A____________��F____________��
(4)���A��D��Ŀ����______________________��
(5)д����������������C����������ͬ���칹��Ľṹ��ʽ________��
a���DZ��Ķ�λ��ȡ�����b.�ܷ���������Ӧ
(6)������������ͼ��ƴ�X��Y�ĺϳ�·�ߡ�
 Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧCB���㷨�������棩 ���ͣ�ѡ����
������Һ��NO3?-��Ũ����500 mL 0.4 mol��L��1 KNO3��Һ��NO3-��Ũ����ȵ���
A��50 mL 4 mol��L��1��KNO3��Һ
B��1 L 0.2 mol��L��1��KNO3��Һ
C��100 mL 0.2 mol��L��1��Ba(NO3)2��Һ
D��500 mL 0.4 mol��L��1��Ba(NO3)2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��7 ���ͣ�ѡ����
����˵���������ȷ����
A��ˮ���������c(H+)��1��10��2mol?L��1��Һ�У����ܴ���:CO32����NH4+��Cl- ��Na+
Bij����ϡ��Һ��pH��a��������Һϡ��1������Һ��pH��b����a��b
C Ba(OH)2��Һ�м��˹�����Al2(SO4)3��Һ�������ӷ���ʽΪ��3Ba2++6OH- +2Al3+ +3SO42-��3BaSO4��+2Al(OH)3��
D���ʵ���Ũ�Ⱦ�Ϊ1 mol?L��1��NaCl��MgCl2���Һ�У�����Cl-����ĿΪ3NA ��NA��ʾ�����ӵ�������ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��6 ���ͣ�ѡ����
 �ж���ͬ���칹�壬���з����������ಢ����������ͬ���칹���ж����֣����������칹��
�ж���ͬ���칹�壬���з����������ಢ����������ͬ���칹���ж����֣����������칹��
A��6 B��5 C��4 D��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��6 ���ͣ�ѡ����
���Ƶ�˼ά�����ǻ�ѧѧϰ���о��г��õ���Ҫ˼ά�����������ý���Ҫ����ʵ���ļ������ȷ������ȷ������������յ�֪ʶ���ж��������ƽ�������ȷ����
| ��ѧ��ʵ | ���ƽ��� |
A | pH��3������ϡ��1000����pH��6 | pH��6������ϡ��1000����pH��9 |
B | �õ������MgCl2�ķ���ұ������þ | �õ������NaCl�ķ���ұ�������� |
C | ��SO2ͨ��BaCl2��Һ���������� | ��SO2ͨ��Ba(NO3)2��Һ��Ҳ�������� |
D | Al��O2��ȼ������Al2O3 | Fe��O2��ȼ������Fe2O3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��5 ���ͣ������
C��Si��Ge��Sn��ͬ��Ԫ�أ�����Ԫ�ص��ʼ��仯�����ڲ��ϡ�ҽҩ�ȷ�������ҪӦ�ã���ش��������⣺
��1��32��Ԫ��Ge��ԭ�Ӻ�������Ų�ʽΪ ��
��2��C��Si��Sn����Ԫ�صĵ����У��ܹ��γɽ���������� ��
��3����֪SnO2�����Ӿ��壬д������Ҫ�������� ����д��2�����ɣ�
��4����֪��
| CH4 | SiH4 | NH3 | PH3 |
�е㣨K�� | 101.7 | 161.2 | 239.7 | 185.4 |
�ֽ��¶ȣ�K�� | 873 | 773 | 1073 | 713.2 |
�����ϱ����������ʵ�������ݣ���ش�
��CH4��SiH4�Ƚϣ�NH3��PH3�Ƚϣ��е�ߵ͵�ԭ���� ��
��CH4��SiH4�Ƚϣ�NH3��PH3�Ƚϣ��ֽ��¶ȸߵ͵�ԭ���� ��
����������ݺ����жϣ�һ��ѹǿ��HF��HCl�Ļ�����彵��ʱ ��
��5��)�ü۲���ӶԻ��������ƶ�SnBr2������Sn��Br�ļ��ǡ�����120�㣨�������������������
(6)Ǧ���������γɵ�ij������ľ����ṹ�ǣ�Pb4+���������������㣬Ba2+���ھ������ģ�O2-���ھ���������ģ��û����ﻯѧʽΪ����������������ÿ��Ba2+�롡��������O2-��λ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��5 ���ͣ�ѡ����
8.34gFeS04��7H20��Ʒ������ˮ���̵���������(��Ʒ�������¶ȱ仯������)����ͼ��ʾ

A���¶�Ϊ78��ʱ��������M�Ļ�ѧʽΪFeSO4?5H2O
B���¶�Ϊl59��ʱ��������N�Ļ�ѧʽΪFeSO4?3H2O
C���ڸ������������£�N�õ�P�Ļ�ѧ����ʽΪFeSO4 FeO+SO3��
FeO+SO3��
D��ȡ����380��ʱ���õ���ƷP����������������650�棬�õ�һ�ֹ�������Q��ͬʱ��������ɫ�������ɣ�Q�Ļ�ѧʽΪFe2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��4 ���ͣ�ѡ����
X��Y��Z��WΪ���ֶ���������Ԫ�أ�����X��Zͬ�壬Y��Zͬ���ڣ�W�Ƕ���������Ԫ����ԭ�Ӱ뾶���ģ�Xԭ�������������Ǻ������ ������3����Y���������������۴�����Ϊ6������˵����ȷ����
������3����Y���������������۴�����Ϊ6������˵����ȷ����
A��YԪ������������Ӧ��ˮ���ﻯѧʽH2YO4
B��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��Z>Y> W
C��X��Z����Ԫ�ص���̬�⻯���У�Z����̬�⻯����ȶ�
D��X��W�γɵ����ֻ������У��������������ʵ���֮�Ⱦ�Ϊ1�U2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�߿���ʦ�Ƽ���ѧ--Ԥ��2 ���ͣ�ѡ����
Cu2O��һ�ְ뵼����ϣ�������ɫ��ѧ������Ƶ���ȡCu2O�ĵ���ʾ��ͼ����ͼ��ʾ������ܷ�ӦΪ��2Cu+H2O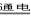 Cu2O+H2��
Cu2O+H2��

����˵������ȷ����
A��ʯī�缫�ϲ�������
B��ͭ�缫�����ĵ缫��ӦΪ��2Cu ��2e��+2OH��= Cu2O+H2O
C��ͭ�缫��ֱ����Դ������
D������0��1 mol����ת��ʱ����0��1 molCu2O����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com