
分析 (1)根据燃烧热的概念及热化学方程式的书写原则写出甲烷燃烧热的热化学方程式;
(2))①C(s)+O2(g)=CO2(g);△H=-394kJ/mol;②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-111kJ/mol,根据盖斯定律,①-②可得目标反应;
(3)根据n=$\frac{V}{{V}_{m}}$计算出CO的物质的量,根据(2)的热化学方程式计算出CO燃烧放出的热量.
解答 解:(1)甲烷的燃烧热为285kJ/mol,则甲烷燃烧热的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-285 kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-285 kJ/mol;
(2)①C(s)+O2(g)=CO2(g);△H=-394kJ/mol;
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-111kJ/mol
根据盖斯定律,①-②可得:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283 kJ/mol,
故答案为:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283 kJ/mol;
(3)标准状况下5.6L二氧化碳的物质的量为:$\frac{5.6L}{22.4L/mol}$=0.25mol,根据热化学方程式CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283 kJ/mol可知,0.25molCO完全燃烧发出的热量为:283kJ/mol×0.25mol=70.75kJ,
故答案为:70.75 kJ.
点评 本题考查了热化学方程式的书写,题目难度中等,明确盖斯定律的内容、燃烧热的概念为解答关键,注意掌握热化学方程式的书写原则,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | x个 | B. | $\frac{x}{4}$个 | C. | $\frac{2x}{3}$个 | D. | $\frac{x}{2}$个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都属于化学变化 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝 | |
| D. | 铝制容器不宜用来长时间存放酸性和碱性食物,也不可长时间存放含盐腌制食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别1-丙醇、甲苯和硝基苯 | |
| B. | 用燃烧法鉴别甲醇、苯和四氯化碳 | |
| C. | 用酸性高锰酸钾溶液鉴别苯和甲苯 | |
| D. | 用溴水鉴别乙苯、苯酚、环己烷和乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


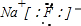 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14组 | B. | 20组 | C. | 26组 | D. | 32组 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com