
| A. | ①③ | B. | ②④⑤ | C. | ①②③④ | D. | ①②③④⑤ |
分析 ①苯酚与溴水常温可以反应,而苯与溴水不能反应,可说明羟基对苯环有影响;
②甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色,可说明苯环对甲基的影响不同;
③苯酚、乙醇都含有羟基,烃基不同;
④都含有苯环,但甲苯含有甲基,甲基对苯环有影响.
⑤官能团不同导致,不是原子团间的相互影响导致;
解答 解:①苯酚和苯都含有苯环,但苯酚含有羟基,苯酚与溴水常温可以反应,而苯与溴水不能反应,可说明羟基对苯环有影响,故正确;
②都含有甲基,但基本含有苯环,乙烷不含苯环,甲苯能使酸性高锰酸钾溶液褪色,而乙烷不能使酸性高锰酸钾溶液褪色,可说明苯环对甲基的影响不同,故正确;
③苯酚、乙醇都含有羟基,烃基不同,苯酚与氢氧化钠溶液可以反应,而乙醇不能与氢氧化钠溶液发生反应,可说明苯环对羟基有影响,故正确;
④甲苯分子中,由于甲基对苯环的影响,导致苯环上的氢原子变得比较活泼,甲苯能够与硝酸作用可得到2,4,6-三硝基甲苯,而苯与硝酸作用得到硝基苯,说明了有机物分子中基团间的相互影响会导致化学性质不同,故正确;
⑤乙烯中含有碳碳双键,性质较活泼能发生加成反应,而乙烷中不含碳碳双键,性质较稳定,不能发生加成反应,所以乙烯和乙烷性质的不同是由于含有的化学键不同而导致的,故错误;
故选C.
点评 本题考查了有机物结构与性质的关系,题目难度中等,注意明确有机物中基团间的相互影响会导致化学性质的不同,要求学生会区分与官能团类型不同对化学性质的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 254gI2( g)中通入 2gH2( g),反应放热 9.48 kJ | |
| B. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ | |
| C. | 反应(1)的产物比反应(2)的产物稳定 | |
| D. | 反应(2)的反应物总能量比反应(1)的反应物总能量低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浊液中存在沉淀溶解平衡:AgCl (s)?Ag+(aq)+Cl-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl | |
| D. | 实验表明实验室可用氨水洗涤银镜反应后的试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | |
| B. | 某溶液中存在大量Fe3+、S2-、Cl-、Na+,加入NaOH溶液发生反应:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 向AlCl3溶液中投入过量的Na:Na+Al3++2H2O=Na++AlO2-+2H2↑ | |
| D. | 将Na2O2固体投入H218O中:2H218O+2Na2O2=4OH-+4Na++18O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
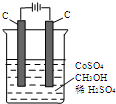 电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:
电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+).现用如图装置模拟上述过程,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊再次成为公众关注的焦点.铊的相关信息如图所示,其中“6s26p1”表示铊原子有6个电子层,最外层有3个电子.下列有关卡片信息解读不正确的是( )| A. | 铊的元素符号为Tl | B. | 铊原子的中子数=204-81=123 | ||
| C. | 铊位于第六周期ⅢA族 | D. | 铊的金属性比铝的金属性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 主要化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低价 | -2 | -3 | -1 | -3 | |||||
| A. | ③的熔点低于⑥的熔点 | |
| B. | 元素①与元素⑥形成的化合物皆为碱性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:⑤>⑦>④ | |
| D. | 元素④形成的氯化物中所有原子周围都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 等浓度的下列稀溶液:①硫酸氢钠 ②乙酸钠 ③醋酸 ④碳酸氢钠 ⑤硝酸钠 ⑥苯酚钠,它们的pH由小到大排列为:③⑤①④②⑥ | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4中c (NH4+)由大到小的顺序是:②>①>④>③ | |
| D. | 在25℃时,将a mol•L-1的氨水与0.01 mol•L-1的盐酸等体积混合反应时溶液中c(NH4+)=c(Cl-).用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
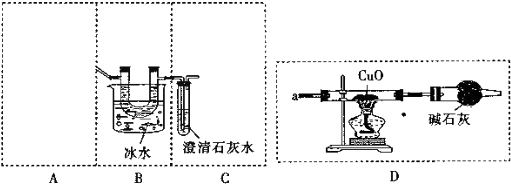
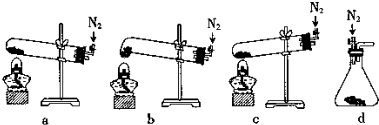
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com