二甲氧基甲烷[CH
2(OCH
3)
2]水溶性好、含氧量高、燃烧完全、烟气排放量低,被认为是一种极具应用前景的柴油添加剂.工业生产CH
2(OCH
3)
2一般是在催化剂作用下,将37%的甲醛水溶液和甲醇混合共热,反应原理如下:HClO+2CH
3OH
CH
2(OCH
3)2+H
2O
(1)某次研究反应时间对产率的影响的实验中,CH
2(OCH
3)
2的浓度随反应时间变化如下表:
| 时间(min) |
20 |
25 |
30 |
40 |
50 |
60 |
| CH2(OCH3)2(mol/L) |
9.02 |
9.10 |
9.18 |
9.23 |
9.30 |
9.32 |
计算25~50min中CH
2(OCH
3)
2的平均生成速率为
.
(2)研究反应的化学平衡常数(记作lnK)与温度(T)的关系如图1所示,判断该反应的△H
0(填“>”、“<”、“=”).
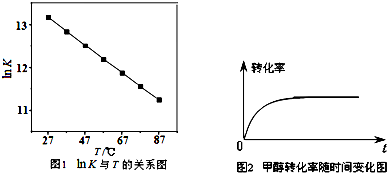
(3)假设在密闭容器中发生上述反应,①达到平衡时下列措施能提高HCHO 转化率的是
.
A.及时从反应体系中分离出CH
2(OCH
3)
2 B.升高反应体系的温度
C.再添加适量甲醇 D.增大压强
②图2是催化剂作用下CH
3OH 转化率随时间变化的趋势曲线图.请在图2中画出相同条件下,不使用催化剂时CH
3OH转化率随时间变化的曲线.
(4)进一步研究发现:甲醛的滴加速率、反应时间、催化剂的量和搅拌速率等对CH
2(OCH
3)
2的工业实际产率(不完全是平衡状态下得出的)也会产生一定影响.欲分别研究甲醛的滴加速率、搅拌速率对产率的影响,某同学设计了三组实验如下表:
影响因素
试验号 |
甲醛的滴加速率(g/min) |
反应时间(min) |
催化剂的量(g) |
搅拌速率 |
| 1 |
|
70 |
2.5 |
30 |
| 2 |
1.0 |
|
|
|
| 3 |
2.5 |
|
|
80 |
①请在上表空格中填入剩余的实验条件数据.
②在研究过程中发现,甲醛的滴加速率过慢或过快均会使CH
2(OCH
3)
2产率降低.请结合该反应的合成机理:
HCHO
HOCH
2OCH
3CH
2(OCH
3)2
试分析甲醛的滴加速率过快时,导致产率较低的原因可能是
.



 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表: 如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题:
如图所示的两个实验装置中,均为500mL氯化铜溶液,试回答下列问题: