
【题目】按要求填空:
(1)稀硫酸跟氧化镁反应(写出离子方程式)
(2)盐酸跟碳酸氢钠溶液反应(写出离子方程式)
(3)Cu2++2OH﹣=Cu(OH)2↓(写出化学方程式)
(4)氢氧化铁胶体制备(写出化学方程式) .
【答案】
(1)2H++MgO=Mg2++H2O
(2)HCO3﹣+H+=H2O+CO2↑
(3)CuCl2+2NaOH=Cu(OH)2↓+2NaCl
(4)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
【解析】(1)稀硫酸跟氧化镁反应生成硫酸镁和水,离子方程式:2H++MgO=Mg2++H2O;
故答案为:2H++MgO=Mg2++H2O;
(2)盐酸跟碳酸氢钠溶液反应生成氯化钠和二氧化碳、水,离子方程式:HCO3﹣+H+=H2O+CO2↑;
故答案为:HCO3﹣+H+=H2O+CO2↑;
(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐,可以表示氯化铜与氢氧化钠反应,方程式:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
故答案为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl;
(4)氯化铁水解生成氢氧化铁胶体和氯化氢,离子方程式:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
故答案为:FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl.
Fe(OH)3(胶体)+3HCl.
(1)氧化镁不可拆;(2)HCO3﹣不可拆;(3)Cu2++2OH﹣=Cu(OH)2↓可以表示可溶性铜盐与强碱反应生成氢氧化铜和可溶性盐;(4)FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl胶体制备要标明条件。
Fe(OH)3(胶体)+3HCl胶体制备要标明条件。


科目:高中化学 来源: 题型:
【题目】为除去某物质中所含的杂质,周佳敏同学做了以下四组实验,其中她所选用的试剂或操作方法正确的是( )

A. ①②③ B. ②③④ C. ①③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 蛋白质是生命活动的主要承担者
B. 核酸是遗传信息的携带者
C. 葡萄糖是动植物细胞内都具有的糖类
D. 在人和动物皮下含量丰富的储能物质是糖原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲从碘水中萃取碘单质,下列说法错误的是( )
A.通过观察可知碘水为黄色溶液
B.可选择四氯化碳作萃取剂
C.应使用分液漏斗进行萃取操作
D.分液后,水层中加入淀粉不变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填空.
(1)如图1是常见仪器的部分结构.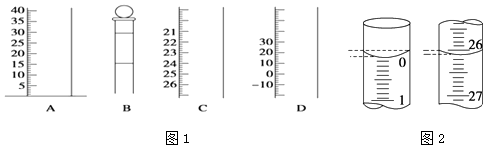
①写出仪器名称BC
②使用前需检查是否漏水的仪器有 .
(2)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 滴定终点时,锥形瓶中颜色变化为 , 且半分钟内颜色不复原.
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(4)若滴定开始和结束时,酸式滴定管中的液面如图2所示,所用盐酸溶液的体积为mL.
(5)某学生根据3次实验分别记录有关数据如表:
滴定 | 待测NaOH溶液的体积/mL | 0.100 0mol/L盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 25.11 | 25.11 |
第二次 | 25.00 | 0.56 | 30.56 | 30.00 |
第三次 | 25.00 | 0.22 | 25.11 | 24.89 |
依据表数据列式计算该NaOH溶液的物质的量浓度 . (保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A。合成线路如下:
}及阻燃剂四溴双酚A。合成线路如下:

已知:① X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]()
②
③![]()
(1)X的分子式为_______________;B的名称是_________________。
(2)B→C还需要的反应试剂及条件是_______________。C→D的反应类型是________。
(3)写出X→Y的化学方程式:_________________________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗_____molNaOH。
(5)符合以下条件的D的同分异构体有_______种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为: ![]() ,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料
,利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,,写出合成该涂料的反应流程图:______________________________________________。
,,写出合成该涂料的反应流程图:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基酸中氨基和羧基数目相同的是中性氨基酸,羧基数目比氨基数目多的是酸性氨基酸,羧基数目比氨基数目少的是碱性氨基酸。这样构成蛋白质的氨基酸可以分为酸性、碱性和中性氨基酸,这种差异决定于氨基酸的( )
A. 羧基 B. 氨基 C. R基 D. 碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用系统命名法命名的有机物名称正确的是( )
A. 2 -甲基--4--乙基戊烷 B. 3, 4, 4--三甲基己烷
C. 2, 3 --二甲基--1--戊烯 D. 2, 2--二甲基-2-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬,通常以二水盐[Cr(CH3COO)2]2·2H2O的形式存在,是深红色晶体,潮湿时易被氧化。不溶于冷水,微溶于乙醇。醋酸亚铬的一种实验室制备装置和实验步骤如下:

易被氧化。不W 于冷水,微游于乙M。
①连接装置,检查装置气密性,加入药品
②__________________________,A中反应液变浅蓝色后,停止滴入盐酸,向C中通入N2
③打开a,关闭b,保持通入N2,再次滴入盐酸
④待C中有大量红色晶体析出,停止滴入盐酸
⑤取C中物质,抽滤,依次用水、乙醇洗涤沉淀,干燥,称重
回答下列问题:
(1)装置A的名称为_______________,导管c的作用是________________________。
(2)补充步骤②中的实验操作__________________________________。
(3)步骤②中Zn与K2Cr2O7反应的离子方程式为____________________________________。
(4)步骤③中出现的现象是______________________,保持通入N2的目的是______________________。
(5)洗涤时依次用水、乙醇,目的依次为___________________________________。
(6)铬离子会污染水,常温下处理上述实验中多余Cr2+时,可向溶液中通入足量的___________(填物质名称或化学式)再加入碱调节pH为6,此时溶液中残留的Cr3+浓度为__________mol/L。已知:Ksp[Cr(OH)3] =6.3×10-31
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com