
【题目】研究金属桥墩的腐蚀及防护是桥梁建设的重要课题。下列有关说法正确的是( )
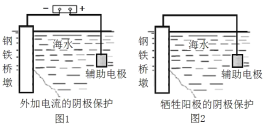
A.图1辅助电极的材料应为铜
B.图1通入的保护电流只与钢铁桥墩和辅助阳极的材料有关
C.图2钢铁桥墩上发生的反应是O2+2H2O+4e-=4OH-
D.钢铁桥墩在河水的腐蚀比海水中更快
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】锰及其化合物在现代工业、农业生产中有着广泛的应用,同时也是实验室中常用的重要试剂。
(1)KMnO4是强氧化剂,其溶液中c(H+)=c(OH-),则常温下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金属离子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若经过处理后的水中c(Mn2+)=1 ×10-6 molL-1,则c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)锰是农作物生长的重要微量元素,用硫酸锰溶液拌种可使农作物产量提高10%~15%。某工厂利用回收的废旧锌锰干电池生成硫酸锰晶体(MnSO4H2O)的流程如图所示:
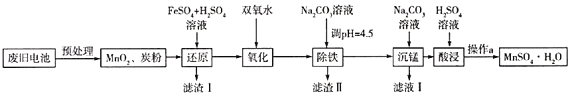
①MnSO4中含有的化学键类型有_______________。
②滤渣Ⅱ的主要成分是____________,滤渣Ⅰ是一种黑色单质,“还原”过程中氧化产物是Fe3+,写出相应反应的离子方程式_________,此反应中MnO2的转化率与温度之间的关系如图所示,则适宜的温度是______________(填字母)。
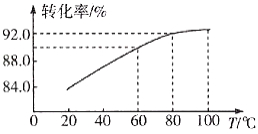
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉锰”中有无色无味的气体生成,还有MnCO36Mn(OH)25H2O生成,写出相应反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品,通过盛有足量I2O5的干燥管,在170 ℃下充分反应;
②用水-乙醇混合溶液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________。(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是( )
|
|
|
|
A.测定一定时间内生成 H2的反应速率 | B.可以进行中和热的测定实验 | C.比较温度对化学反应速率的影响 | D.比较Cu2+、Fe3+对 H2O2分解速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的绝热容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的体积 V与所得混合溶液温度 T的关系如图所示。 下列说法错误的是

A.25℃时 pH=2 的 HA 溶液中 HA 的电离度约为 10%
B.M 点溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 点溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的过程中水的电离程度先增大后减小,M 点水电离程度小于 P 点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是第四周期第ⅥA族元素,是人体内不可或缺的微量元素,H2Se是制备新型光伏太阳能电池、半导体材料和金属硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反应H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代数式表示)。
(2)T℃时,向一恒容密闭容器中加入3molH2和1molSe,发生反应H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情况可判断反应达到平衡状态的是__(填字母代号)。
a.气体的密度不变 b.v(H2)=v(H2Se)
c.气体的压强不变 d.气体的平均摩尔质量不变
②当反应达到平衡后,将平衡混合气体通入气体液化分离器使H2Se气体转化为H2Se液体,并将分离出的H2再次通入发生反应的密闭容器中继续与Se反应时,Se的转化率会提高。请用化学平衡理论解释:_。
③以5小时内得到的H2Se为产量指标,且温度、压强对H2Se产率的影响如图1、图2所示:
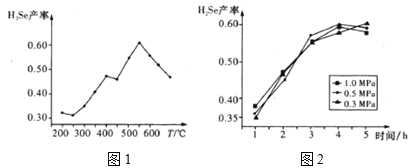
则制备H2Se的最佳温度和压强为__。
(3)已知常温下H2Se的电离平衡常数K1=1.3×10-4、K2=5.0×10-11,则NaHSe溶液呈__(填“酸性”或“碱性”),请通过计算数据说明__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲线如图,已知HX的电离平衡常数为1.0×10-9,下列说法错误的是( )

A.①处pH约为5
B.②处pH一定大于7
C.水的电离程度:③>纯水>②
D.②中离子浓度大小关系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
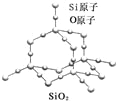
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,下列描述正确的是( )
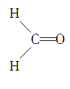
A. 甲醛分子中有4个σ键
B. 甲醛分子中的C原子为sp3杂化
C. 甲醛分子中的O原子为sp杂化
D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com