
| A. | 原子半径:M>Z>Y>X | |
| B. | 气态氢化物:X<Z | |
| C. | X的氧化物一定是非极性分子 | |
| D. | Y单质可用于航空航天合金材料的制备 |
分析 短周期元素X、Y、Z、M 的原子序数依次增大,元素X 的一种单质是高硬度的宝石,故X为C;Y2+的电子层结构与氖相同,故Y为Mg;
室温下M 的单质为淡黄色固体,故M为S,而Z的原子序数大于Mg而小于S,且质子数为偶数,故Z为Si,据此分析.
解答 解:短周期元素X、Y、Z、M 的原子序数依次增大,元素X 的一种单质是高硬度的宝石,故X为C;Y2+的电子层结构与氖相同,故Y为Mg;
室温下M 的单质为淡黄色固体,故M为S,而Z的原子序数大于Mg而小于S,且质子数为偶数,故Z为Si.
A、电子层数越大,则半径越大,故X的半径最小;而当电子层数相同时,核电荷数越大,则半径越小,故半径大小关系为:Y>Z>M>X,故A错误;
B、非金属性越强,则氢化物的稳定性越强,故气态氢化物的稳定性X>Z,故B错误;
C、X的氧化物有CO和CO2,CO是极性分子,故C错误;
D、镁合金的强度高、密度小,是常用的航空航天的合金材料,故D正确.
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,正确推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 化学实验室中的蔗糖纯度很高,可用来食用 | |
| B. | 实验室中制取完有毒气体,开窗通风即可 | |
| C. | 为了节约用水,实验室中用过的废洗液,可以用来冲洗厕所 | |
| D. | 不能用手接触药品,不要把鼻孔凑到容器口去闻药品的气味,不得尝任何药品的味道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
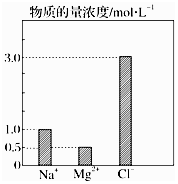 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
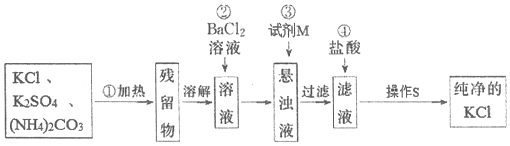
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水的电离平衡曲线如图示,试回答下列问题:
已知水的电离平衡曲线如图示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 名称 | 性状 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 |
| 苯甲醛 | 无色液体,苦杏仁味 | -26 | 178.1 | 1.041 5 | 微溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4 | 248 | 1.265 9 | 微溶 |
| 苯甲醇 | 无色液体,有芳香味 | -15.3 | 205.35 | 1.041 9 | 微溶 |
| 乙醚 | 无色透明液体, 有特殊刺激性气味 | -116.3 | 34.6 | 0.71 | 不溶 |
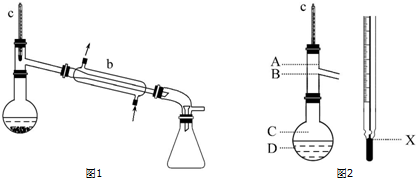
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1的蔗糖溶液 | B. | 0.01 mol•L-1的CaCl2溶液 | ||
| C. | 0.02 mol•L-1的NaCl溶液 | D. | 0.02 mol•L-1的CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色一氧化氮气体与空气接触变为红棕色 | |
| B. | 往盐酸中滴加紫色石蕊试液,溶液变红色 | |
| C. | 向硫酸铜溶液中滴加氢氧化钠溶液,出现白色沉淀 | |
| D. | 将足量二氧化硫气体通入品红溶液,红色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com