
����Ŀ��H2��g��+I2��g��2HI��g���Ѿ��ﵽƽ��״̬�ı�־�ǣ� ��
��c��H2��=c��I2��=c��HI��
��c��H2����c��I2����c��HI��=1��1��2
��c��H2����c��I2����c��HI��������ʱ����ı�
�ܵ�λʱ��������nmolH2��ͬʱ����2nmolHI
�ݵ�λʱ��������n mol H2��ͬʱ����n mol I2
��Ӧ����v��H2��=v��I2��= ![]() v��HI��
v��HI��
��һ��H��H�����ѵ�ͬʱ������H��I������
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯
���¶Ⱥ�ѹǿһ��ʱ�����������ܶȲ��ٱ仯
����һ������������ƽ����Է����������ٱ仯��
A.5��
B.4��
C.3��
D.2��
���𰸡�B
���������⣺��ƽ��ʱc��H2����c��I2����c��HI�����߿�����ȣ�Ҳ���ܲ��ȣ�������ʵij�ʼŨ�ȼ�ת�����йأ��ʴ���
��ƽ��ʱŨ��c��H2����c��I2����c��HI������Ϊ1��1��2��Ҳ���ܲ��ȣ�������ʵij�ʼŨ�ȼ�ת�����йأ��ʴ���
��c��H2����c��I2����c��HI��������ʱ����ı䣬˵�����淴Ӧ��ȣ�����ȷ��
�ܵ�λʱ��������nmolH2 �� ��Ч������2nmolHI��ͬʱ����2nmolHI������ȷ��
�ݵ�λʱ��������n mol H2��ͬʱ����n mol I2 �� �������淴Ӧ���ʴ���
��ֻҪ��Ӧ�������ͷ��Ϸ�Ӧ����v��H2��=v��I2��= ![]() v��HI�����ʴ���
v��HI�����ʴ���
��һ��H��H�����ѵ�Ч������H��I���γ�ͬʱ������H��I�����ѣ����淴Ӧ������ȣ�����ȷ��
���¶Ⱥ����һ��ʱ��������ѹǿһֱ���ٱ仯���ʴ���
���¶Ⱥ����һ��ʱ������������ɫ���ٱ仯��˵����������Ũ�Ȳ��䣬��Ӧ��ƽ��״̬������ȷ��
���¶Ⱥ�ѹǿһ��ʱ�����������ܶ�һֱ���ٱ仯���ʴ���
����һ������������ƽ����Է�������һֱ���ٱ仯���ʴ���
��ѡB��
�����㾫����������Ĺؼ��������⻯ѧƽ��״̬���жϵ����֪ʶ������״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������(K2FeO4)�Ѿ����㷺Ӧ����ˮ�������档������ص������Գ���������أ���һ�ּ����������������ۡ�ɱ����һ�������Ч���ˮ������������ĸ�����������ֽ⣬��198���������ȶ��ġ����������ˮ�����������漰�ı仯������(����)
�������ʵı��ԡ��������ʵ�������������۳���������ˮ�⡡����ɫ��Ӧ����������ԭ��Ӧ
A.�٢ڢۢ�B.�٢ۢܢ�C.�ڢۢܢ�D.�ڢۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У������ý�����������Ӧ�Ƶõ���
A. CuCl2 B. FeCl2 C. CaCl2 D. ZnCl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ����ͨ���������AlCl3��ұ����
B. HF���ȶ��Ժ�ǿ������Ϊ����Ӽ����γ����
C. �Ǽ��Լ���ֻ������˫ԭ�ӵ��ʷ�����
D. �ֽⷴӦ�������ȷ�Ӧ�����Ϸ�Ӧ���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�����������������������������������������( )
A. 16OH�� B. Mg2+ C. 16OD�� D. D316O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3,�����й衢�������ʡ��Ʊ�������ͼ��ʾ:
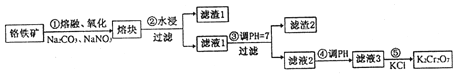
�ش���������:
��1������ٵ���Ҫ��ӦΪ:FeO��Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2��������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ__________���ò��費��ʹ���մ�������ԭ����______��
Na2CrO4+ Fe2O3+CO2+ NaNO2��������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ__________���ò��費��ʹ���մ�������ԭ����______��
��2������1�к������Ľ���Ԫ����_________������2����Ҫ�ɷ���________���������ʡ�
��3������������Һ2��pHʹ֮��______��������������С������ԭ����______�������ӷ���ʽ��ʾ����
��4��ij������76 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7�����յõ���Ʒ41.16kg�������Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������ʵ�ʵ����δ��������ԭ������
A.��������B.���ᶡ��C.������D.��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ơ�ʳ�ס����ǡ����۵Ⱦ�Ϊ��ͥ�����г������ʣ�������Щ��������ɵ�ʵ����
�������Ƿ״� ������ʳ�κ�С�մ� �������ܷ������ᣨ ��
A. �٢� B. �٢� C. �٢ڢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ӹ����������仯�������������������е����÷����˾�仯��
��1���Ŵ��й��Ĵ���֮һ��˾��������Ȼ��ʯ�Ƴɵģ�����Ҫ�ɷ���_____(����ĸ���)
A.Fe B.FeO C.Fe3O4 D.Fe2O3
��2���ִ���������������ѭ���ֽ�ˮ�������Ĺ�������ͼ��ʾ�������������¶��������,���¶ȵ���570��ʱ,Fe3O4(s)��CO(g)��Ӧ�õ��IJ�����Fe(s)��CO2(g),�谭ѭ����Ӧ�Ľ��С�

����֪:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g) ��H1=+19.3kJ��mol-1
3FeO(s)+CO2(g) ��H1=+19.3kJ��mol-1
3FeO(s)+H2O(g)![]() Fe3O4(s)+H2(g) ��H2=-57.2kJ��mol-1
Fe3O4(s)+H2(g) ��H2=-57.2kJ��mol-1
C(s)+CO2(g)![]() 2CO(g) ��H3=+172.4kJ��mol-1
2CO(g) ��H3=+172.4kJ��mol-1
��������ѭ���ѽ�ˮ�������ܷ�Ӧ���Ȼ�ѧ����ʽ��_________________��
����ͼ��ʾ��������һ��ʱ,Fe3O4(s)��CO(g)��Ӧ��ƽ��ʱCO(g)������ٷֺ������¶�(T)�ı仯��ϵ��
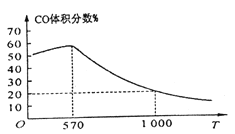
i. ���¶ȵ���570��ʱ,���ڷ�ӦFe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g) ���¶Ƚ��ͣ�CO��ת����_____ (����������������С������������)��
3Fe(s)+4CO2(g) ���¶Ƚ��ͣ�CO��ת����_____ (����������������С������������)��
ii. ���¶ȸ���570��ʱ�����¶�����,��ӦFe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g)ƽ�ⳣ���ı仯������______������������������С������������);1000��ʱ,�÷�Ӧ�Ļ�ѧƽ�ⳣ������ֵ��__________��
3FeO(s)+CO2(g)ƽ�ⳣ���ı仯������______������������������С������������);1000��ʱ,�÷�Ӧ�Ļ�ѧƽ�ⳣ������ֵ��__________��
��3���ٹ��϶��������ɫȾ����³ʿ���ĺϳɷ�������:

���ֽⷴӦii�����ӷ���ʽ��_____________��
�ڻ�����³ʿ���ϳ�ԭ���ɼ��ʳƷ��CN-,��������:
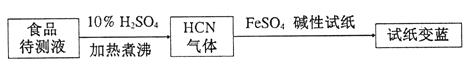
����ֽ������֤��ʳƷ�к���CN-,����ͼ��ʱ��ֽ��FeSO4������____________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com