
【题目】氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
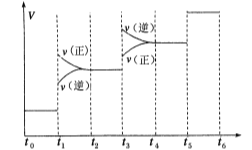
图中t1时引起平衡移动的条件可能是 ,其中表示平衡混合物中NH3的含量最高的一段时间是 ,若t0-t1,t1-t3,t3-t5这三段平衡常数分别用K1,K2,K3表示,那么K1,K2,K3的大小关系是____________。
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
【答案】
(1)增大压强;t2-t3 ;K3<K1=K2 (5分)
(2)向左;不改变(3)![]() (5分)
(5分)
【解析】(1)N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol,反应是放热反应,反应前后气体体积减小,依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时是升高温度,正逆反应速率都增大,平衡逆向移动,NH3的含量减少;t5时是加入催化剂,正逆反应速率不变,NH3的含量不变,所以平衡混合物中NH3的含量最高的一段时间是t2-t3;平衡常数随温度变化,升高温度平衡左移,平衡常数减小,那么K1,K2,K3的大小关系是:K1=K2>K3;
2NH3(g) ΔH=-92.4 kJ/mol,反应是放热反应,反应前后气体体积减小,依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时是升高温度,正逆反应速率都增大,平衡逆向移动,NH3的含量减少;t5时是加入催化剂,正逆反应速率不变,NH3的含量不变,所以平衡混合物中NH3的含量最高的一段时间是t2-t3;平衡常数随温度变化,升高温度平衡左移,平衡常数减小,那么K1,K2,K3的大小关系是:K1=K2>K3;
(2)若在恒温、恒压条件下向平衡体系中通入氩气,为保持恒压,体积增大,平衡向逆向进行;催化剂改变反应速率,不改变化学平衡,反应焓变不变;
(3)温度为T℃时,将2a mol H2和 a mol N2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数可以列出三段式计算平衡浓度,依据平衡常数概念计算:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始 2amol/L 4amol/L 0
反应 amol/L 3amol/L 2amol/L
平衡 amol/L amol/L 2amol/L
所以化学平衡常数K=![]() =
=![]() (mol/L)-2;
(mol/L)-2;


科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(6)实验时所用盐酸及NaOH溶液的密度均为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“在2支大小相同的试管中各装入2~3 mL约5%的H2O2溶液,再向其中1支试管中滴入1~2滴1 mol/L FeCl3溶液,对比观察现象。”
Ⅰ.体验H2O2分解的实验意义
(1)指出本实验的探究目的:________。
(2)写出H2O2分解反应方程式并标出电子转移的方向和数目:________。
(3)在盛有滴入FeCl3溶液的H2O2溶液中,可观察到溶液中 ________ ;溶液温度升高;溶液由浅黄色变成棕黄色,最后恢复为浅黄色。
Ⅱ.探讨FeCl3催化H2O2分解的机理
(4)Fe3+催化H2O2分解时涉及2步反应:
第1步,Fe3+氧化H2O2:2Fe3++H2O2═2Fe2++O2↑+2H+
第2步,H2O2氧化Fe2+:________(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知:P4(白磷)+3O2(g)= P4O6(g)的反应热△H=-1638 kJ·mol1 ,白磷和P4O6的分子结构如图所示,化学键的键能(kJ·mol1):P—P:198 P—O:360,则断开1molO2所需要的能量为 kJ

II.已知:①CO(g)+1/2O2(g)=CO2(g) △H=-141kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-883kJ·mol-1
(1)利用CO、H2化合制得1mol气态甲醇的热化学方程式为 ;
(2)若在恒温2L密闭容器中,将1molCO与3mol H2充分反应,当吸收能量为129KJ时,此时H2的转化率为 ,平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图Ⅰ表示反应A+B=C+D的ΔH=(a-c) kJ·mol-1
B. 图Ⅱ表示不同温度下水溶液中H+和OH-的浓度变化曲线,图中a点对应温度高于b点
C. 图Ⅲ表示N2+3H2![]() 2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
2NH3的v逆随时间变化曲线,由图知t1时刻可能减小了容器内的压强
D. 图Ⅳ表示向醋酸稀溶液中加水时溶液的导电性变化,图中p点pH大于q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素是参与生物生长发育和新陈代谢所必需的物质,中学生每天需要补充一定量的维生素C。下列物质中维生素C含量最丰富的是
A. 鱼 B. 虾 C. 牛肉 D. 橘子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com