
| A.向Ca(OH)2溶液中通入过量的CO2 | B.向NaAlO2溶液中滴入过量的盐酸 |
| C.向氯化铝溶液中滴加过量的氨水 | D.向Al2(SO4)3溶液中滴入过量的NaOH溶液 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
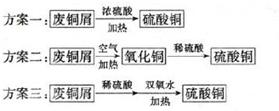
科目:高中化学 来源:不详 题型:填空题
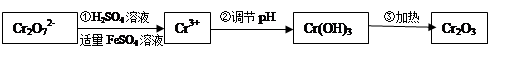
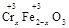 ·y
·y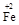 O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(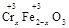 ·y
·y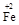 O)化学式是 。
O)化学式是 。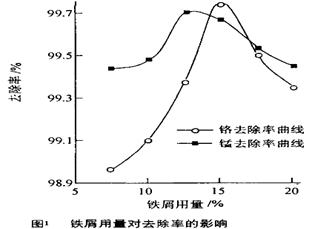
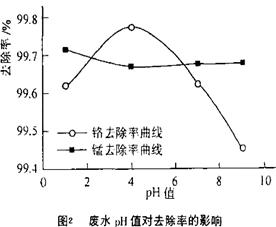
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.用分液的方法分离水和汽油的混合物 |
| B.用过滤的方法分离饱和食盐水与沙子的混合物。 |
| C.蒸馏时,应使温度计水银球插入液面以下 |
| D.蒸发结晶时应将溶液蒸干后再停止加热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碳和SiO2反应能置换出硅,说明碳的非金属性比硅强 |
| B.SO2通入碘水中,碘水褪色,反应的离子方程式为SO2+I2+2H2O=SO42-+2HI+2H+ |
| C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- |
D.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com