
【题目】按要求回答下列问题:
(1)标准状况下,1.12LCH4的质量为_______g。
(2)与3.2gSO2所含的O原子数相等的NO2的质量为_______g。
(3)配制500mL1.0mol·L-1CuSO4溶液时,在移液洗涤后,摇动容量瓶有少量液体溅出,则所配溶液物质的量浓变会_______(选填“偏高”、“偏低”、“无影响”)。
(4)把2.0mol·L-1Na2SO4溶液和1.0mol·L-1H2SO4溶液等体积混合(假设混合后溶液的体积为两者体积之和),则SO42-的物质的量浓度为_______mol·L-1。
(5)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2。该反应中氧化剂与还原剂的物质的最之比为_______。
【答案】 0.8g 2.3g 偏低 1.5 3∶2
【解析】(1)标准状况下,气体摩尔体积为22.4L/mol,CH4的摩尔质量为16g/mol,所以1.12LCH4的质量=![]() ×16g/mol=0.8g;
×16g/mol=0.8g;
(2)已知SO2的摩尔质量为64g/mol,则3.2gSO2所含的O原子的物质的量为![]() 0.1mol,又NO2的摩尔质量为46g/mol,则含有0.1molO原子的NO2的物质的量为0.05mol,其质量为0.05mol×46g/mol=2.3g;
0.1mol,又NO2的摩尔质量为46g/mol,则含有0.1molO原子的NO2的物质的量为0.05mol,其质量为0.05mol×46g/mol=2.3g;
(3)在移液洗涤后,摇动容量瓶有少量液体溅出,导致溶质量减少,使所配溶液物质的量浓度偏低;
(4)设两种溶液的体积都是1L,则2.0mol·L-1Na2SO4溶液中n(SO42-)=1L×2.0mol·L-1=2.0mol,1.0mol·L-1H2SO4溶液n(SO42-)=1L×1.0mol·L-1=1.0mol,所以混合后溶液中的n(SO42-)=3.0mol,故c(SO42-)=![]() =1.5mol·L-1;
=1.5mol·L-1;
(5)已知反应8NH3+3Cl2=6NH4Cl+N2中Cl元素的化合价从0价降低为-1价,Cl2作氧化剂,N元素化合价从-3价升高为0价,NH3作还原剂,根据转移电子守恒可得氧化剂与还原剂的物质的最之比 3∶2。


科目:高中化学 来源: 题型:
【题目】根据电解质溶液的知识,回答下列问题:
已知0.1mol·L-1的NaHSO4溶液中H+的浓度为0.1mol·L-1,
(1)写出NaHSO4在水溶液中的电离方程式:________________________________________。
(2)若将NaHSO4与Ba(OH)2在溶液中按照物质的量之比1:1混合,离子方程式为_______________。
(3)若向Ba(OH)2溶液中滴加NaHSO4溶液至溶液恰好呈中性,反应的离子方程式为___。
(4)向NaAlO2中滴加NaHSO4溶液,现象为:________________;请你用离子方程式解释产生上述现象的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿( 主要成分MnO2)制高锰酸钾的流程如下(部分条件和产物省略):
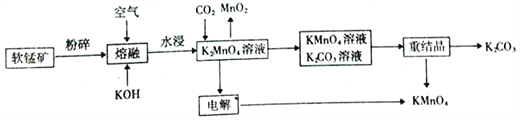
请回答下列问题:
(1)在“水浸”过程中,提高K2MnO4浸出率(浸出的K2MnO4质量与“熔块”质量之比)的措施有_______( 至少写出两点)。
(2)“熔融”过程中发生反应的化学方程式为___________。
(3)CO2 与K2MnO4反应的离子方程式为___________。
(4)“电解”过程中使用的是惰性电极,则:
①阳极反应的方程式为__________。
②阴极附近溶液的pH将__________。(填“增大”“减小” 或“ 不变”)。
(5)在上述过程中产生的Mn2+会对环境造成污染。工业上,通过调节pH使废水中的Mn2+形成Mn(OH)2 沉淀。当pH=10时,溶液中的c(Mn2+)=______(已知:Ksp[Mn(OH)2]=2.0×10-13。相关数据均在常温下测定)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是( )
A.水的离子积KW只与温度有关,但水的电离程度一定会受外加酸、碱、盐的影响
B.若HA的Ka=1.7×10﹣5 , BOH的Kb=1.7×10﹣5 , 则HA溶液中的c(H+)与BOH中的c(OH﹣)相等
C.将0.2mol/L HA溶液和0.1mol/L NaOH溶液等体积混合,则反应后的混合液中:c(OH﹣)+c(A﹣)=c(H+)+c(HA)
D.Mg(OH)2能溶于NH4Cl浓溶液的主要原因是NH4+结合OH﹣使沉淀溶解平衡发生正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
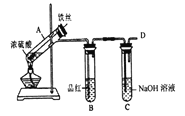
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,78g的苯含有3nA个![]() 双键
双键
B.1L 0.1 mol·L-1的NH4Cl溶液中有0.1nA个NH4+
C.标准状况下,22.4 L SO2与CO2混合物含有2nA个O原子
D.常温下,5.6 g铁块投入足量浓硝酸中失去0.3nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在工农业生产及日常生活中应用非常广泛.
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 ,
请写出Cu2S与O2反应生成Cu与SO2的热反应方程式: .
(2)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl﹣) 的关系如图1.①当c(Cl﹣)=9molL﹣1时,溶液中主要的3种含铜物种浓度大小关系为 . 
②在c(Cl﹣)=1molL﹣1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为(任写一个).
(3)电解Na2HPO3溶液可得到亚磷酸,装置如图2
(说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过)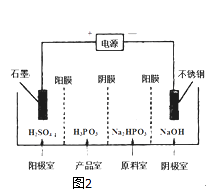
①阳极的电极反应式为: .
②产品室中反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)下列实验操作或对实验事实的描述中,正确的是(填序号)
①为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
②化学药品着火,都要立即用水或泡沫灭火器灭火
③配制一定物质的量浓度的稀硫酸溶液时,量取浓硫酸后的量筒要用蒸馏水洗涤,并把洗涤液转入容量瓶中
④配制一定物质的量浓度的溶液在定容时,俯视容量瓶的刻线,会使配制的浓度偏高
⑤检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
(2)将下列物质进行分类:
①11H 与13H ②O2与O3 ③乙醇与甲醚(CH3﹣O﹣CH3)④ 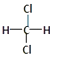 与
与 
⑤CH3CH2CH2CH3与CH3﹣CH(CH3)﹣CH3⑥C60与金刚石 ⑦乙醇与甘油
互为同位素的是(填编号,下同);互为同素异形体的是互为同分异构体的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com