
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
分析 向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变,若溶液中含有碳酸根离子或碳酸氯根离了,加入盐酸后,溶液中阴离子种类会减少,所以溶液中含有二价铁离子和硝酸根离子;二价铁离子和氢氧根离子生成沉淀,所以溶液中没有氢氧根离子;溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol,根据溶液中阴阳离子电荷相等,二价铁离子和氯离子、硝酸根离子所带电荷相等,溶液中没有氢氧根离子,所以阴离子是硫酸根离子,溶液中呈现二价的阳离子有镁离子,所以溶液中含有镁离子,若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体是氧化铁和氧化镁,根据铁原子、镁原子守恒计算固体质量,据此分析解答.
解答 解:(1)往溶液中加入的是过量的盐酸,如果有碳酸根离子或碳酸氢跟离子的话会完全反应生成二氧化碳,所以就不可能保证阴离子种类没有变化,
故答案为:一定不;HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化;
(2)若向原溶液中加入足量的盐酸,有无色气体生成,反应后溶液中阴离子种类没有变化,根据表中的离子,可以推知是 Fe2+、NO3-在酸性环境下生成的一氧化氮,所以一定含有氯离子,加入盐酸,溶液中阴离子种类不变,所以原来溶液中含有Cl-,若只含有氯离子和硝酸根离子,二者的量均为1mol,根据电何守恒是不可能的,所以还含有硫酸根离子,不能有钡离子,再根据电荷守恒确定还含有一种带有两个正电荷的镁离子,
故答案为:Cl-、NO3-、SO42-;Fe2+、Mg2+;
(3)向原溶液中加入足量的盐酸,有无色气体NO生成的离子反应方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后产生的沉淀是Fe(OH)2、Mg(OH)2,将沉淀过滤、洗涤、干燥灼烧到恒重,得到固体是Fe2O3和MgO,根据原子守恒,则生成0.5molFe2O3和1mol的MgO,质量为:0.5mol×160g/mol+1mol×40g/mol=120g,故答案为:120.
点评 本题考查了常见阴阳离子的检验,难度不大,易错点是:二价铁离子能和硝酸反应生成无色气体.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验步骤 | |
| A | 比较CH3COOH和H2CO3酸性强弱 | 测同浓度的Na2CO3、CH3COONa溶液的pH |
| B | 比较S和Si非金属性强弱 | 向Na2SiO3溶液中通入SO2出现浑浊 |
| C | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶、过滤 |
| D | 探究蔗糖水解产物中是否含有葡萄糖 | 取少量蔗糖溶液加稀硫酸,水浴加热几分钟后,再加入新制的氢氧化铜悬浊液并加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
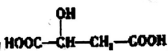 ,下列说法错误的是( )
,下列说法错误的是( )| A. | lmol苹果酸可与2 molNaOH发生中和反应 | |
| B. | 一定条件下,苹果酸与乙酸或乙醇均能发生酯化反应 | |
| C. |  与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | lmol苹果酸与足量金属Na反应生成1.5molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子排布完全相同的两种微粒的化学性质一定相同 | |
| B. | 单原子形成的离子一定具有稀有气体元素原子的核外电子排布 | |
| C. | 核外电子排布相同的两种粒子一定属于同种元素 | |
| D. | 不存在质子数和电子数分别相同的阳离子和阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | I1 | I2 | I3 | I4 | I5 | I6 | I7 | |
| A的电离能 | 1402 | 2856 | 4578 | 7475 | 9445 | 53267 | … | |
| B的电离能 | 1012 | 1907 | 2914 | 4964 | 6274 | 21267 | 25431 | |
| 序号 | I8 | I9 | I10 | I11 | I12 | I13 | I14 | … |
| B的电离能 | 29872 | 35905 | 40950 | 46261 | 54110 | 59024 | 271791 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol 氨气充分溶解在1L水中 | |
| B. | 将10克质量分数98%的硫酸与990克水混合 | |
| C. | 将25克胆矾溶于水配成1L 溶液 | |
| D. | 将10 mL1mol/L的盐酸与90 mL水充分混合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com