
| A. | 向NH4HCO3溶液中加入少量的Ba(OH)2溶液并加热:Ba2++2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+BaCO3↓ | |
| B. | 电解氯化镁溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 少量CO2通入苯酚钠溶液:2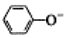 +CO2+H2O→2 +CO2+H2O→2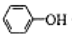 +CO32- +CO32- | |
| D. | 向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ |
分析 A.氢氧化钡少量,只有碳酸氢根离子参与反应,铵根离子不反应;
B.镁离子与氢氧根离子生成氢氧化镁沉淀;
C.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢钠;
D.反应后溶液呈中性,则铝离子恰好反应生成氢氧化铝沉淀.
解答 解:A.向NH4HCO3溶液中加入少量的Ba(OH)2溶液,铵根离子不反应,正确的离子方程式为:Ba2++2OH-+2HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+2H2O+BaCO3↓,故A错误;
B.电解氯化镁溶液,反应生成氯气、氢气和氢氧化镁沉淀,正确的离子方程式为:Mg2++2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+Mg(OH)2↓,故B错误;
C.少量CO2通入苯酚钠溶液,反应生成苯酚和碳酸氢钠,正确的离子方程式为: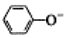 +CO2+H2O→
+CO2+H2O→ +HCO3-,故C错误;
+HCO3-,故C错误;
D.向明矾溶液中滴加Ba(OH)2溶液至溶液呈中性反应生成硫酸钾、硫酸钡和氢氧化铝,反应的离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源:2016-2017学年四川省高二上教学质检化学试卷(解析版) 题型:选择题
下列说法正确的是
A. HF、HCl、HBr、HI的熔沸点依次升高
B. N2与CO互为等电子体,具有相似的空间结构
C. 乙醇分子与水分子之间只存在范德华力
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
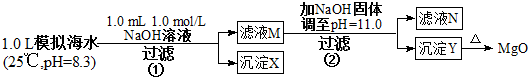
| 海水中的离子浓度(mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3 |
| 0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
| A. | 沉淀物X为CaCO3,MgCO3 | |
| B. | 滤液M中存在Mg2+,不存在Ca2+ | |
| C. | 滤液N中存在Mg2+、Ca2+ | |
| D. | 步骤②中若改为加入8 g NaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol•L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 数据模糊A |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 35 | 数据模糊B |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 数据模糊C |
| 7 | 0.10 | 丝 | 1.0 | 50 | 数据模糊D | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 未测数据 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、蒸发皿 | CuSO4溶液的浓缩结晶 |
| B | 烧杯、玻璃棒、胶头滴管、滤纸 | 用盐酸除去BaSO4中少量BaCO3 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用固体NaCl配制0.5mol•L-1的溶液 |
| D | 烧杯、分液漏斗 | 用CCl4分离碘水中的碘 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 根据要求回答问题:
根据要求回答问题: .
. .分子中可能处于同一平面上的碳原子最多有4个.
.分子中可能处于同一平面上的碳原子最多有4个.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com