
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
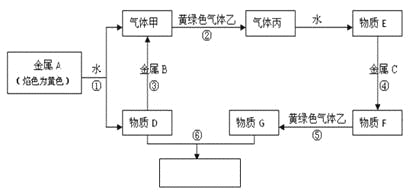
请根据以上信息回答下列问题:
(1)写出下列物质的化学式
A、______B、______C、________乙__________
(2)写出下列反应化学方程式:
反应①___________________________________
反应③___________________________________
(3)写出下列反应离子方程式:
反应④___________________________________
反应⑥___________________________________
【答案】Na Al Fe C12 2Na+2H2O=2NaOH+H2↑ 2 Al+2NaOH+2H2O=2NaAlO2+3H2↑ Fe+2H+= Fe2++H2↑ Fe3++3OH-=Fe(OH)3↓
【解析】
金属A焰色为黄色,所以A为钠;钠与水反应生成氢氧化钠和氢气,所以气体甲为氢气、物质D为氢氧化钠;气体乙为黄绿色,所以乙是氯气;气体丙为氯化氢,物质E为盐酸;金属B能与氢氧化钠反应,所以B为铝;氢氧化钠与物质G反应生成红棕色沉淀,所以物质G是氯化铁,金属C为铁。
(1)根据上述分析,A为Na,B为Al,C为Fe,乙为C12;
(2)反应①的方程式为2Na+2H2O=2NaOH+H2↑;
反应③的方程式为2 Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)反应④的离子方程式为Fe +2H+= Fe2++H2↑;
反应⑥的离子方程式为Fe3++3OH-=Fe(OH) 3↓。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(1)写出碳酸的第二步电离平衡常数表达式![]() _____________
_____________
(2)在相同条件下,试比较醋酸、碳酸和亚硫酸的酸性强弱____ > ____ > ____。____
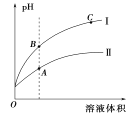
(3)图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化:
①图像中,曲线I表示的酸是____(填化学式)。
②A、B、C三点中,水的电离程度最大的是____(填字母)
(4)同c(H+)同体积的的醋酸和盐酸溶液分别用氢氧化钠中和,所需氢氧化钠物质的量较大的是 _________________________.
(5)下列粒子组不能大量共存的是_____________________________。
A. H2SO3、HCO3- B. HSO3-、CO32- C.HSO3-、HCO3- D. HCO3-、SO32- E.H2SO3、CO32- F. H 2SO3、SO32- G. H2CO3、HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“地沟油”泛指生活中产生的、不宜继续食用的油脂。地沟油经脱胶、洗涤、脱色等预处理,用来制备脂肪酸钠(RCOONa),在消除危害的同时,还可用于处理含Cu2+的废水。
已知:2RCOO-+Cu2+![]() (RCOO)2Cu
(RCOO)2Cu
(1)可利用活性炭对地沟油进行脱色处理,这利用了活性炭的____________性。
(2)取30 mL三油酸甘油酯在不同条件下水解,实验结果如下表所示。
序号 | 试剂 | 温度 | 时间 | 水解率 |
a | 20 mL3 mol/L H2SO4 | 95℃ | 3小时 | 52.1% |
b | 20 mL 6 mol/LNaOH | 70℃ | 1.5 | 97.7% |
①实验a中,三油酸甘油酯水解的产物是____________(填物质名称)。
②对比实验a、b可以得到的结论有____________(写出2条)。
(3)将预处理后的地沟油水解,用水解所得液体去除Cu2+的实验过程如下图所示。

①RCOONa属于____________(填“离子化合物”或“共价化合物”)。
②实验表明,硫酸酸化后液体的pH会影响Cu2+的去除率。实验测得,pH=5时Cu2+的去除率低于pH=7时的,其原因为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
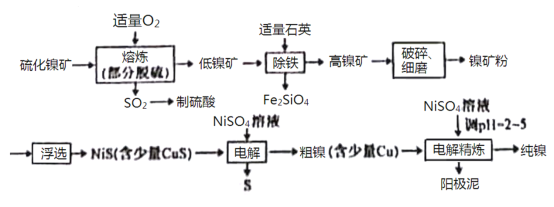
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨催化分解既可防治氨气污染,又能得到氢能源。回答下列问题:
(1)已知:①4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH1=-1266.6kJ·mol-1
②H2(g)+![]() O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
O2(g)=H2O(1)ΔH2=-285.8kJ·mol-1
③H2O(1)=H2O(g)ΔH3=+44.0kJ·mol-1
反应①的热力学趋势很大(平衡常数很大),其原因是________________。NH3分解的热化学方程式为________________。
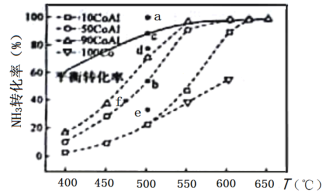
(2)在Co—Al催化剂体系中,压强p0下氨气以一定流速通过反应器,得到不同催化剂下NH3转化率随温度变化的关系如图所示。活化能最小的催化剂为________________:升高温度,NH3的平衡转化率增大,其原因是________________;温度一定时,如果增大气体流速,则b点对应的点可能________________(填“a”“c”“d”“e”或“f”)。
(3)温度为T时,体积为1L的密闭容器中加入0.8molNH3和0.1molH2,30min达到平衡时,N2的体积分数为20%,则T时反应2NH3(g)N2(g)+3H2(g)的平衡常数K=________________mol2·L-2,NH3的分解率为________________,达到平衡后再加入0.8molNH3和0.1molH2,NH3的转化率________________(填“增大”“不变”或“减小”)。
(4)将氨溶解于水也可消除氨气的污染。常温下,向10mL0.1mol·L-1氨水中逐滴加入相同浓度的CH3COOH溶液,在滴加过程中![]() =________________(填标号).
=________________(填标号).
A.始终碱小B.始终增大C.先减小后增大D.先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量的二氧化锰和40mL 10mol/L浓盐酸充分反应制氯气,下列说法正确的是
A.该实验中共消耗0.1 mol MnO2,生成标准状况下2.24L氯气
B.氯气有毒、有刺激性气味,常用澄清石灰水吸收多余的氯气
C.氯气可以用向下排空气法或排水法收集
D.在该反应中二氧化锰作氧化剂,浓盐酸作还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com