
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X阴离子的电子数与Y原子的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素名称为___________;五种元素的原子半径从小到大的顺序是(用元素符号表示)______________。
(2)Z、X两元素按原子数目比1∶3和2∶4构成分子A和B,用电子式表示A的形成过程_______________,B的结构式为________。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为________,其最高价氧化物对应的水化物化学式为________。
(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为____________________。
【答案】氧元素 H<O<N<C<Al ![]()
 34 H2SeO4 4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。
34 H2SeO4 4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。
【解析】
Y的最外层电子数是次外层电子数的2倍,推出Y为C,X阴离子的电子数与C原子内层电子数相等,则X为H,Z、L是空气中含量最多的两种元素,且原子序数依次增大,则Z为N,L为O,M是地壳中含量最高的金属元素,则M为Al,据此解答。
(1)根据上述推断,L为氧元素,半径一看电子层数,电子层数越多,半径最大,二看原子序数,电子层数相等,半径随着原子序数的递增而减小,因此是H<O<N<C<Al;
(2)A为NH3,B为N2H4,电子式形成的过程为: ,B的结构式为:
,B的结构式为: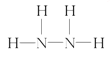 ;
;
(3)Se与O属于同一主族,且Se原子比O原子多两个电子层,则Se位于第四周期,原子序数16+18=34,最高价氧化物对应水化物化学式为H2SeO4;
(4)一定条件下,Al与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分,因此乙是氧化铝。已知该反应生成1 mol乙时放出536 kJ热量,所以热化学方程式为4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)ΔH=-1 072kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.CH3COOCH2CH3 与CH3CH2COOCH3 中均含有甲基、乙基和酯基,为同一种物质
B.![]() 和
和 ![]() 为同一物质
为同一物质
C.CH3CH2CH2CH2CH3 和CH3CH2CH(CH3)2 互为同素异形体
D.CH3CH2OH 和 CH2OHCHOHCH2OH 具有相同的官能团,互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
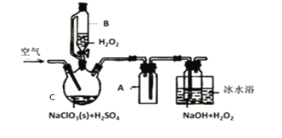
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
(1)冰水浴冷却的目的是___。
(2)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,__。
(3)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①___(用离子方程式表示)②H2O2+Cl2=2Cl-+O2+2H+
(4)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为___。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组的两物质作用时,反应条件或反应物用量的改变对生成物没有影响的是
A.Na2O2与CO2B.Na与O2C.NaOH与AlCl3D.C与O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 砷化镓为第三代半导体,以其为材料制造的灯泡寿命长.耗能少。已知砷化镓的晶胞结构如图所示。请回答下列问题:

(1)下列说法正确的是__________(填序号)
A.砷化镓晶胞结构与NaCl相同 B.第一电离能 As>Ga
C.电负性 As>Ga D.原子半径 As>Ga
(2)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的方程式为_____________________________;
(3)AsH3空间形状为___________;已知(CH3)3 Ga为非极性分子,则其中镓原子的杂化方式为____________;
Ⅱ. 金属铜的导电性仅次于银,居金属中的第二位,大量用于电气工业。
(4)请解释金属铜能导电的原因_______________________, Cu2+的核外电子排布式为_______________________。
(5)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有_________和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)镁原子由1s22s22p63s2→1s22s22p63p2时原子释放能量,由基态转化成激发态____。
(2)价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素______。
(3)凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键______。
(4)24Cr原子的电子排布式是1s22s22p63s23p63d44s2______。
(5) 金属铜属于六方最密堆积结构,金属镁属于面心立方最密堆积结构______。
(6)氯化钠晶体中,每个Na+周围距离相等的Na+共有12个______。
(7)金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子______。
(8) 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同______。
(9)干冰晶体中,每个CO2分子周围紧邻12个CO2分子______。
(10) 模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
模型中的小黑点表示电子在原子核外出现的概率密度的形象描述______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH![]() CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
CH3CH2CH2CHO;利用如图装置用正丁醇合成正丁醛相关数据如表:
物质 | 沸点/℃ | 密度 / gcm-3 | 水中溶解性 |
|
正丁醇 | 117.2 | 0.8109 | 微溶 | |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是
A.为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B.当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
C.反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D.向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.4g由铁、铜组成的混合粉末加入100mL5.0molL﹣1FeCl3溶液中,充分反应后,剩余固体质量为3.2g。下列说法正确的是( )
A.原固体混合物中:n(Cu):n(Fe)=2:1
B.反应后溶液中的溶质有FeCl2、FeCl3、CuCl2
C.反应后溶液中:n(Fe2+)+n(Cu2+)=0.8mol
D.剩余固体是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
B. 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA
C. 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA
D. 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com