
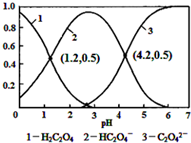
| A. | pH=1.2溶液中:c(K+)+c(H+)═c(OH-)+c(H2C2O4) | |
| B. | pH=2.7溶液中:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=1000 | |
| C. | 将相同物质的量KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2 | |
| D. | 向pH=1.2的溶液中加KOH溶液将pH增大至4.2的过程中水的电离度一定增大 |
分析 A.pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,结合电荷守恒和物料守恒判断;
B.由图象计算Ka1、Ka2,由电离常数可知:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=$\frac{K{a}_{1}}{K{a}_{2}}$;
C.KHC2O4和K2C2O4的物质的量相同,但如配成不同浓度的溶液,则pH不一定为4.2;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液氢离子浓度减小,对水的电离抑制的程度减小.
解答 解:A.pH=1.2时,H2C2O4、HC2O4-的物质的量分数相等,且c(K+)+c(H+)=c(OH-)+c(HC2O4-),则c(K+)+c(H+)=c(OH-)+c(H2C2O4),故A正确;
B.由图象可知pH=1.2时,c(HC2O4-)=c(H2C2O4),则Ka1=c(H+)=10-1.2,pH=4.2时,c(HC2O4-)=c(C2O42-),Ka2=c(H+)=10-4.2,由电离常数可知:$\frac{{c}^{2}(H{C}_{2}{O}_{4}^{-})}{c({H}_{2}{C}_{2}{O}_{4})}$×c(C2O42-)=$\frac{K{a}_{1}}{K{a}_{2}}$=1000,故B正确;
C.将相同物质的量KHC2O4和K2C2O4固体完全溶于水,可配成不同浓度的溶液,溶液浓度不同,pH不一定为定值,即不一定为4.2,故C错误;
D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,故D正确.
故选C.
点评 本题考查酸碱混合物的定性判断和计算,侧重于学生的分析能力和计算能力的考查,注意把握图象的含义,B信选项为易错点,注意对平衡常数的理解与灵活运用.


科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 Na2CO3溶液中,含CO${\;}_{3}^{2-}$数目小于NA | |
| B. | 1mol FeCl3完全转化为氢氧化铁胶体后,其中胶体粒子数目为NA | |
| C. | 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA | |
| D. | 1mol苯和苯甲酸的混合物完全燃烧时消耗O2的分子数为7.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
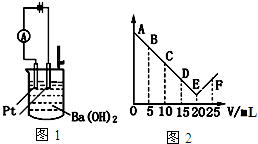
| A. | 此酸的化学式为HNO3 | |
| B. | 处于C点时溶液中导电的阳离子主要是Ba2+、NH4+ | |
| C. | 烧杯中刚加入酸时,观察不到有白色沉淀生成 | |
| D. | 从A→E电流强度I变小的主要原因是生成难溶的盐和难电离的水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
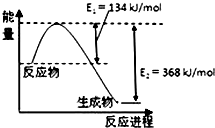 氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的元素,氮及其化合物在工农业生产、生活中有着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
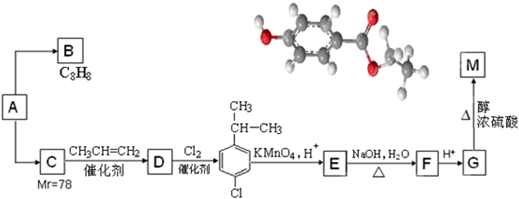
 .
.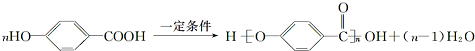 .
.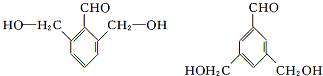 (任意一种).
(任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
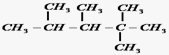
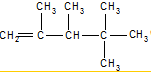 、
、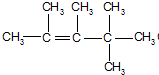 、
、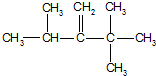 .
.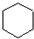 ,E是CH3CH3.
,E是CH3CH3.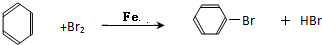 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉既可做漂白棉麻纸张的溧白剂,又可做游泳池及环境的消毒剂 | |
| B. | 氮肥包括铵态氮肥、硝态氮肥和尿素 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 硅胶可用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
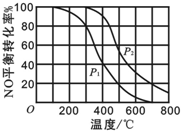 (1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.
(1)汽车尾气是造成空气污染产生雾霾的原因之一.其中涉及的反应2NO(g)+O2?2NO2(g)在其他条件不变达平衡时.分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com