
【题目】在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2CH3OH+H2O.在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是

A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时![]() 减小
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=![]() molL﹣1min﹣1
molL﹣1min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
【答案】D
【解析】
A.图象分析可知先拐先平温度高,T1<T2,温度越高平衡时生成甲醇物质的量越小,说明正反应为放热反应,则温度越高,平衡常数越小,该反应在T1时的平衡常数比T2时的大,故A错误;
B.分析可知T1<T2,A点反应体系从T1变到T2,升温平衡逆向进行,达到平衡时![]() 增大,故B错误;
增大,故B错误;
C.T2下达到平衡状态甲醇物质的量nB,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=![]() molL﹣1min﹣1=
molL﹣1min﹣1=![]() molL﹣1min﹣1,故C错误;
molL﹣1min﹣1,故C错误;
D.T1下,若反应达到平衡后CO2转化率为a,
CO2+ 3H2 CH3OH+ H2O,
起始量(mol) 1 3 0 0
变化量(mol) a 3a a a
平衡量(mol) 1﹣a 3﹣3a a a
则容器内的压强与起始压强之比=![]() =
=![]() =
=![]() ,故D正确;
,故D正确;
答案:D。


科目:高中化学 来源: 题型:
【题目】核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.(A-N+2)molD.![]() (A-N+8)mol
(A-N+8)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入2mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:

(1)写出OA段所发生反应的离子方程式____、____。
(2)当加入45mL盐酸时,产生CO2的体积为___mL(标准状况)。
(3)混合物中氢氧化钠质量分数是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯是重要的化工原料。下列叙述正确的是
A. 甲烷、乙烯是同分异构体
B. 可用酸性高锰酸钾溶液来区别甲烷和乙烯
C. 甲烷与氯气在光照条件下发生置换反应
D. 乙烯与水在一定条件下发生取代反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示。若Z原子的K层与M层电子数和等于其L层电子数,下列说法不正确的是
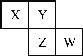
A. Y的气态简单氢化物比X的稳定
B. 含W元素的酸一定比含Z元素的酸的酸性强
C. Y的非金属性比Z的强
D. X与Y形成的化合物有的能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。一种回收废旧磷酸亚铁锂电池正极片(主要成分LiFePO4、炭黑和铝箔)中金属的流程如下:

(1)步骤①中“碱溶”反应的化学方程式为_____。
(2)步骤②中反应的离子方程式为_____。若用H2O2代替HNO3,其优点是_____。
(3)步骤③沉淀的主要成分是_____。
(4)步骤④中生成含Li沉淀_____(填“能”或“不能”)用硫酸钠代替碳酸钠,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种新型可降解的生物高分子材料,以丙烯(CH2=CH﹣CH3)为主要原料合成G的流程路线如图所示:
![]()
(1)聚合物G的结构简式是_____。
(2)E分子中含氧官能团的名称是_____。
(3)A转化为B的化学方程式是_____。
(4)C有多种同分异构体,写出其中能发生水解反应的有机物的结构简式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】达康书记又追问环保局长:那么垃圾处理中,能随便焚烧吗?焚烧垃圾会降低GDP的。在焚烧垃圾过程中发生了( )
A. 吸热的非氧化还原反应B. 吸热的氧化还原反应
C. 放热的非氧化还原反应D. 放热的氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com