
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源(左池),以Al作阳极、Pb作阴极,电解稀硫酸(右池),使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O ![]() Al2O3+3H2↑。
Al2O3+3H2↑。
关闭K,电解过程中,以下判断正确的是

A. 两池中H+均移向Pb电极
B. 左池每消耗3 mol Pb,右池生成2 mol Al2O3
C. 左池Pb电极质量增加,右池Pb电极质量不变
D. 左池正极反应:PbO2+4H++2e-=Pb2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:

下列叙述正确的是
A. 用溴水可鉴别化合物X和Z B. 化合物Y的分子式为C6H13NO2
C. 化合物Z中含有手性碳原子 D. 1mol化合物Z可以与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_____________。
(2)反应前A的物质的量浓度是_________。
(3)10 s末,生成物D的浓度为________。
(4)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;②增大A的浓度_____;③恒容下充入氖气________。
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
(6)将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)NH3(g)+HI(g),2HI(g)H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L1,c(HI)=4mol·L1,则NH3的浓度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下图是由常见元素组成的一些单质及其化合物之间的转化关系图。A是由单质C在D中燃烧生成的淡黄色固体。B是最常见的无色液体,常温常压下,D、F、K均为无色无刺激性气味的气体。H和I焰色反应均为黄色。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________。
(2)反应①的离子方程式为__________。
(3)反应②的化学方程式为_________。
(4)上述转化H→I的反应离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a kJ/mol
CH3OH(g)+H2O(g) ΔH= a kJ/mol
①保持温度、体积一定,能说明上述反应达到平衡状态的是________。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图所示,则a______0(填“>”或“<”)。

(2)工业生产中需对空气中的CO进行监测。
①氯化钯(PdCl2)溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为________。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为________。

(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图所示。乙酸的生成速率主要取决于温度影响的范围是________。

(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(CO32-)=_______。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是_______(填“a→b”或“b→a”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
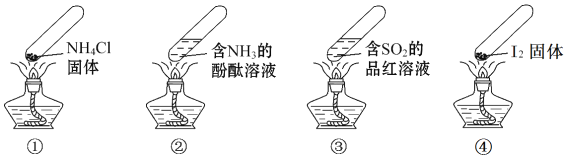
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)广泛应用于有机合成、染料、颜料、催化剂等工业。它是一种白色粉末,微溶于水,不溶于乙醇、稀硝酸及稀硫酸,可溶于氨水、浓盐酸,并生成配合物NH4[CuCl2];能在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是实验室制备氯化亚铜的流程图及实验装置图。
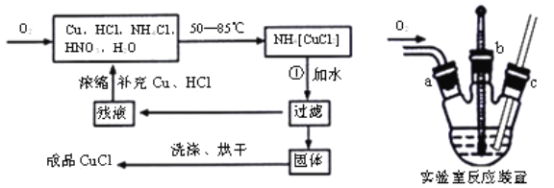
实验药品:铜丝20g、氯化铵20g、65%硝酸l0mL、36%盐酸15mL、水。
(1)请写出①的化学方程式____________________________________。
(2)本实验中通入O2的速率不宜过大,宜选择下图中的____(填字母序号)方案,并说明选择该装置的理由__________________________________________。
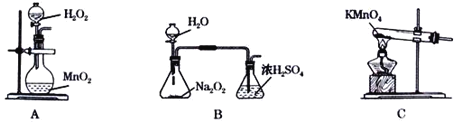
(3)电炉加热升温至50℃时停止加热,反应快速进行,当烧瓶中液面上方的现象为_____时,停止通入氧气,打开瓶塞,沿C口倾出反应液于l000mL大烧杯中,加水500mL,即刻有大量白色沉淀析出。
(4)关于该实验过程中,下列说法正确的是_________________。
A 实验开始时,温度计显示反应液温度可能低于室温。
B 流程中过滤操作,可以采用真空抽滤的方式,洗涤固体可以用95%的酒精。
C 该实验流程中,残液中补充HCl的主要作用是抑制产物的水解。
D 反应装置中使用长导管的目的是防止三颈烧瓶内气压过大。
(5)氯化亚铜的定量
①称取成品0.25g置于预先放入玻璃珠30粒和l0mL过量的FeCl3溶液的250mL锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.l0 mol·L-1硫酸铈标准溶液滴至绿色出现为终点并记录读数,再重复实验二次,测得数据如下表。(已知:CuCl + FeCl3 = CuCl2 + FeCl2 ,Fe2+ + Ce4+ = Fe3+ + Ce3+)
实验序号 | 1 | 2 | 3 |
滴定起始读数(mL) | 0.75 | 0.50 | 0.80 |
滴定终点读数(mL) | 24.70 | 24.95 | 24.85 |
④数据处理:计算得CuCl的纯度为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com