
【题目】某种食品的配料标签如图所示:

(1)该配料中,富含糖类的物质是_________,富含蛋白质的物质是_________,富含油脂的物质是________;
(2)该配料中的________有防腐作用。碳酸氢钠受热分解,产生的气体使食品膨松,该过程的化学方程式为____________;
(3)用于包装该食品的聚乙烯塑料包装属于_________(填字母);
a.有机高分子材料 b.无机非金属材料 c.金属材料
【答案】小麦粉、淀粉 鸡蛋 棕榈油 苯甲酸钠 2NaHCO3![]() Na2CO3+H2O+CO2↑ a
Na2CO3+H2O+CO2↑ a
【解析】
(1)小麦粉、淀粉富含糖类;鸡蛋、瘦肉类、蛋类、豆类等富含蛋白质,植物油和动物脂肪富含油脂;
(2)苯甲酸钠是防腐剂,碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
(3)聚乙烯是由乙烯CH2=CH2通过加聚反应产生的有机高分子化合物。
(1)小麦粉、淀粉中含有丰富的淀粉,淀粉是多糖,属于糖类,为人提供能量;
鸡蛋中蛋白主要成分是蛋白质,所以富含蛋白质的物质是鸡蛋;
植物油和动物脂肪富含油脂,因此棕榈油是植物油,含丰富的油脂;
(2)苯甲酸钠是防腐剂有防腐作用,是食品中的防腐剂;
碳酸氢钠受热分解生成碳酸钠、H2O和CO2,反应的化学方程式为2NaHCO3![]() Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
(3)聚乙烯是由乙烯CH2=CH2通过加聚反应产生的有机高分子化合物,故合理选项是a。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,11g CO2含有的共用电子对数为0.5NA
B. 1mol Na分别与足量的O2反应生成Na2O或Na2O2,失去的电子数均为NA
C. 通常状况下,39 g Na2O2固体中含有的离子总数为2NA
D. 滴加到沸水中的FeCl3溶液有5.6 g Fe3+发生水解,则生成的胶粒数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解度g/l00g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:

①在50mL三颈烧瓶中投入几粒沸石,将18.5 mL正丁醇和13.4 mL冰醋酸(过量),3~4滴浓硫酸按一定顺序均匀混合,安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中依次用水洗,10% Na2CO3洗,再水洗,最后转移至锥形瓶并干燥。
③将干燥后的乙酸正丁酯加入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。
请回答有关问题:
(1)写出任意一种正丁醇同类的同分异构体的结构简式___________。
(2)仪器A中发生反应的化学方程式为___________________。
(3)步骤①向三颈烧瓶中依次加入的药品是:__________________。
(4)步骤②中,用 10%Na2CO3溶液洗涤有机层,该步操作的目的是____________。
(5)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏___,(填“高”或“低”)原因是__。
(6)该实验生成的乙酸正丁酯的产率是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。
(1)自然界中主要的锂矿物为锂辉石、锂云母、透锂长石和磷锂铝石等。为鉴定某矿石中是否含有锂元素,可以采用焰色反应来进行鉴定,当观察到火焰呈________,可以认为存在锂元素。
A.紫红色 B.紫色 C.黄色
(2)工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:

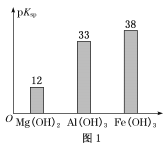
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图1。
回答下列问题:
①锂辉石的主要成分为LiAlSi2O6,其氧化物的形式为________。
②为提高“酸化焙烧”效率,常采取的措施是________。
③向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ 。(已知:完全沉淀后离子浓度低于1×l0-5) mol/L)
④“滤渣2”的主要化学成分为 _______。
⑤“沉锂”过程中加入的沉淀剂为饱和的 __________(化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“ ___________”步骤中。
⑥Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为__________。
(3)利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LiCoO2+C6![]() LixC6+Li1-xCoO2其工作原理如图2。
LixC6+Li1-xCoO2其工作原理如图2。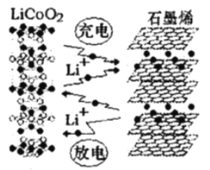
下列关于该电池的说法正确的是___________(填字母)。
A.过程1为放电过程
B.该电池若用隔膜可选用质子交换膜
C.石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
D.充电时,LiCoO2极发生的电极反应为LiCoO2-xe-=xLi++Li1-xCoO2
E.对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 molL-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是
A.该溶液的pH=4
B.此溶液中,HA约有0.1%发生电离
C.由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D.加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
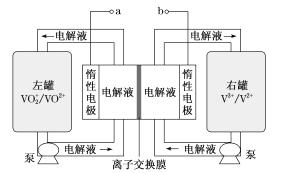
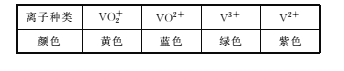
【题目】全钒液流储能电池是一种新型的绿色环保储能系统(工作原理如图,电解液含硫酸)。该电池负载工作时,左罐颜色由黄色变为蓝色。
 4
4
下列说法错误的是
A.该电池工作原理为VO2++VO2++2H+![]() VO2++V3++H2O
VO2++V3++H2O
B.a和b接用电器时,左罐电动势小于右罐,电解液中的H+通过离子交换膜向左罐移动
C.电池储能时,电池负极溶液颜色变为紫色
D.电池无论是负载还是储能,每转移1 mol电子,均消耗1 mol氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
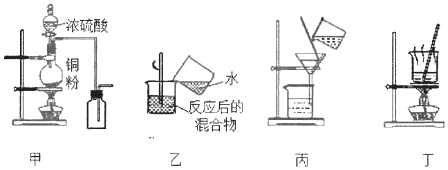
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用绿矾制备还原铁粉的工业流程如下:

(1)制备FeCO3时,选用的加料方式是_______________(填字母)。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________。
(3)干燥过程主要是为了脱去游离水和结晶水,过程中会有少量FeCO3·nH2O被空气氧化为FeOOH,其化学方程式为________________。
(4)取干燥后的FeCO3样品12.49 g隔绝空气焙烧至600℃,质量变为8.00 g,继续加热最终得到Fe 6.16 g,则600℃产物的可能组成为_______________(写出一种即可),计算FeCO3样品中FeCO3与FeOOH的质量_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
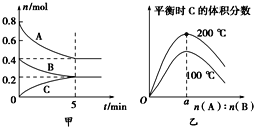
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com