
关于pH的测定,下列说法正确的是( )
|
| A. | pH试纸在使用之前应用蒸馏水润湿 |
|
| B. | 用广泛pH试纸测得某盐酸的pH=2.3 |
|
| C. | 利用酸碱指示剂可以测溶液的pH |
|
| D. | pH计是精确测定溶液pH的仪器 |
考点:
测定溶液pH的方法.
分析:
A、pH试纸在使用之前应用蒸馏水润湿,测定溶液PH会稀释溶液浓度;
B、PH是粗略测定溶液酸碱性,测定数值为整数;
C、酸碱指示剂只能测定溶液酸碱性和溶液PH范围;
D、pH计是精确测定溶液pH的仪器.
解答:
解:A、pH试纸在使用之前应用蒸馏水润湿,测定溶液PH会稀释溶液浓度,测定结果会产生误差,故A错误;
B、PH是粗略测定溶液酸碱性,测定数值为整数,不能为小数,故B错误;
C、酸碱指示剂只能测定溶液酸碱性和溶液PH范围,不能测定溶液PH,故C错误;
D、pH计是精确测定溶液pH的仪器,用于测定溶液pH,故D正确;
故选D.
点评:
本题考查了溶液PH的测定方法和试纸使用方法,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:
如图反应是有名的Diels﹣Alder反应的一个著名化学反应方程式:分析上述有机化学反应,可判断其反应的类型是( )
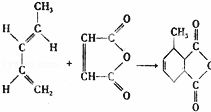
|
| A. | 取代反应 | B. | 加成反应 | C. | 氧化反应 | D. | 酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A的相对分子质量为60.为进一步测定A的化学式,现取6.0gA完全燃烧,得到二氧化碳和水蒸气.将产物先后通过足量的浓硫酸和碱石灰,两者分别增重3.6g和8.8g (假设每步反应完全).
(1)该有机物的最简式是 ,分子式是 ;
(2)该有机物能与碳酸氢钠反应产生二氧化碳,推断该有机物的结构简式是 ;
(3)该有机物与碳酸氢钠反应的离子方程式是 .
(4)该有机物不具有的性质是
A.与金属钠反应 B.与稀硫酸反应
C.发生酯化反应D.使酸性高锰酸钾溶液褪色.
查看答案和解析>>
科目:高中化学 来源: 题型:
分离苯和苯酚的混合物,通常采用的方法是( )
|
| A. | 加水振荡后,用分液漏斗分离 |
|
| B. | 加稀盐酸振荡后,用分液漏斗分离 |
|
| C. | 加入浓溴水振荡后过滤 |
|
| D. | 加NaOH溶液振荡后,用分液漏斗分离,取下层液体通入CO2或加入适量盐酸后,再用分液漏斗分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂含苯酚的工业废水处理的流程图如图:
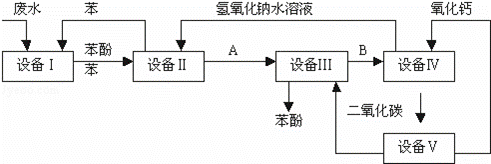
(1)上述流程里,设备Ⅰ中进行的是 操作(填写操作名称).
(2)由设备Ⅱ进入设备Ⅲ的物质A是 ,
(3)在设备Ⅲ中发生反应的化学方程式为: .
(4)在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和.
(5)上图中,能循环使用的物质是CO2、CaO、NaOH水溶液、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸.恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
|
| A. | △H1>△H2>△H3 | B. | △H2>△H3>△H1 | C. | △H1=△H2=△H3 | D. | △H1>△H3>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | pH=7的溶液一定显中性 |
|
| B. | pH=6的溶液一定显酸性 |
|
| C. | c(H+)<c(OH﹣)的溶液一定显碱性 |
|
| D. | c(OH﹣)=1×10﹣6 mol/L的溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠二水合物Na2Cr2O7·2H2O广泛用作氧化剂、金属表面精整、皮革制作等。以铬矿石(Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如下:
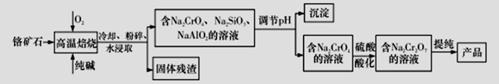
请回答下列问题:
(1)写出Cr2O3在高温焙烧生成Na2CrO4的化学方程式__________________________。
(2)调节pH后得到的沉淀主要是____________(填写化学式).
(3)写出用硫酸酸化使Na2CrO4转化为Na2Cr2O7的原理(写出离子方程式并加以文字说明):__________。
(4)氯化铬酸CrO2Cl2是红色液体,它可由Na2Cr2O7与NaCl的固体混合物和浓硫酸小心加热下制得,写出制备CrO2Cl2的化学反应方程式____________________________。
(5)某化工厂采用石墨作电极电解Na2CrO4溶液,实现Na2CrO4转化为Na2Cr2O7的生产,其原理如图所示。

①通电后阳极区溶液的颜色变化为__________________________________。
②写出电解Na2CrO4溶液制备Na2Cr2O7的化学反应方程式:_______________________________。
③在电流为I A.通电时间为t s后,两极共收集到3.36 L气体(标准状况下),则阿伏加德罗常数的表达式NA =_____mol-1(己知电子的电量为1.6* 10-19C)。
(6)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要的O2的质量,单位:mg·L-1),现有某水样200.00 mL,酸化后加入c1 mol/L的Na2Cr2O7溶液V1 mL,使水中的还原性物质完全被氧化(还原产物为Cr3+ );再用c2 mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。则该水样的COD为_____________mg·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com