
【题目】亚氯酸钠(NaClO2)是一种高效漂白剂,工业设计生产NaClO2的主要流程如下:
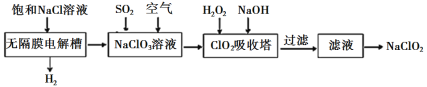
已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用,ClO2气体在中性和碱性溶液中不能稳定存在。
②NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。
(1)写出无隔膜电解槽中阳极的电极反应式:_________。
(2)生成ClO2的反应中需用酸进行酸化,你认为最宜选用的酸为______________(写酸的名称)。
(3)ClO2吸收塔中发生反应的离子方程式为________,H2O2的电子式为________。
(4)请补充从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②______;③用38℃~60℃热水洗涤; ④低于60℃干燥,得到成品。
(5)NaClO2溶液浓度含量可用碘量法测定,其原理为在稀硫酸介质中,NaClO2能定量地将碘离子氧化成碘,以淀粉为指示剂,用0.1000 mol·L1的硫代硫酸钠标准溶液滴定碘而确定NaClO2。已知:2I2 + 2Na2S2O3=2NaI + Na2S4O6。
取NaClO2溶液体积V1 mL加入到适量的稀硫酸和KI溶液中,反应完毕用Na2S2O3滴定反应后的溶液,消耗V2 mL Na2S2O3溶液,则NaClO2的浓度为_______g·L1(杂质不参与反应,NaClO2中的氯元素被还原为Cl)。
【答案】Cl6e+6OH=ClO3-+3H2O 稀硫酸 2OH+2ClO2+H2O2=2ClO2-+2H2O+O2 ![]() 趁热过滤
趁热过滤 ![]()
【解析】
由流程可知,电解饱和食盐水得到氯酸钠溶液,向氯酸钠溶液中通入二氧化硫和空气,氯酸钠被还原为二氧化氯并被吹入吸收塔中,在碱性条件下,二氧化氯被双氧水还原生成亚氯酸钠。
(1)无隔膜电解槽中阳极上氯离子被氧化为氯酸根,电极反应式为Cl6e+6OH=ClO3-+3H2O。
(2)生成ClO2的反应中需用酸进行酸化,由于二氧化硫是较强的还原剂,故不能用强氧化性的酸(如硝酸,可以被还原为氮的氧化物),由于氯酸钠有强氧化性,也不能用还原性酸(如盐酸,可以被氧化为氯气),故为了防止气体中引入其他杂质,最宜选用的酸为稀硫酸。
(3)在碱性条件下,二氧化氯被双氧水还原生成亚氯酸钠,双氧水被氧化为氧气,故ClO2吸收塔中发生反应的离子方程式为2OH+2ClO2+H2O2=2ClO2-+2H2O+O2,H2O2是共价化合物,其电子式为![]() 。
。
(4)NaClO2饱和溶液在温度低于38℃时析出晶体NaClO2·3H2O,温度高于38℃时析出晶体NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。因此,从滤液获得NaClO2的操作步骤:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃热水洗涤;④低于60℃干燥,得到成品。
(5)由ClO2- +4I- +4H+=Cl- +2I2+2H2O、2I2 + 2Na2S2O3=2NaI + Na2S4O6可知,NaClO2~2I2 ~2Na2S2O3,则n(NaClO2)=0.5 n(Na2S2O3)= 0.5 V2 10-3L0.1000 mol·L1=5 V2 10-5 mol,则NaClO2的浓度为![]()
![]() g·L1。
g·L1。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】2019 年 9 月,我国科研人员研制出 Ti-H-Fe 双温区催化剂,其中 Ti-H 区域和Fe 区域的温度差可超过100℃。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法错误的是
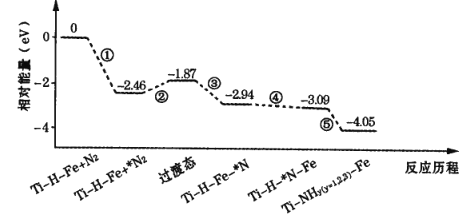
A.①②③在 Fe 区域发生,④⑤在Ti-H区域发生
B.在高温区加快了反应速率,低温区提高了氨的产率
C.该历程中能量变化最大的是2. 46eV,是氮分子中氮氮三键的断裂过程
D.使用 Ti-H-Fe 双温区催化合成氨,不会改变合成氨反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定作氧化剂 |
B | NaHCO3溶液与NaAlO2溶液混合,立即产生白色沉淀 | 结合H+的能力:AlO2->CO32- |
C | 向盛有Cu2O的试管中加入足量稀硫酸,溶液变为蓝色,试管底有红色沉淀 | 氧化性:H+>Cu2+ |
D | 向2支盛有2mL0.1mol/LNaOH溶液的试管中分别滴入2滴0.1mol/LAlCl3、MgCl2溶液,振荡,前者无沉淀,后者有白色沉淀 | Ksp[Al(OH)3]>Ksp[Mg(OH)2] |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中既是化合反应又是氧化还原反应的是
A.CaO + H2O = Ca(OH)2B.Ca + Cl2![]() CaCl2
CaCl2
C.Fe + CuSO4 = FeSO4 + CuD.H2SO4 + BaCl2 = BaSO4 ↓+ 2HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )

A. 三种酸的电离常数关系:KHA>KHB>KHD
B. 滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里 Ca2+的浓度一般采用mg/cm3 来表示。抽取一定体积的血样加适量的草酸钱[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液与之反应即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
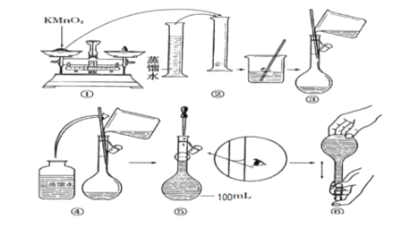
(实验探究一 : 配制酸性KMnO4标准溶液)如图是配制l00mL酸性KMnO4标准溶液的过程示意图 :
(1)请你观察图示判断其中不正确的操作有________________(填序号)。
(2)配置上述溶液,需要使用的玻璃仪器是量筒、烧杯、玻璃棒、_______________(填名称)。
(3)按照图示的操作配制溶液,所得KMnO4标准溶液的浓度将________________(填 偏大 或 偏小 或者 无影响,下同)。如未冷却至室温就进行液体转移,则其所配的氯化钾溶液的浓度_____;若用托盘天平时错把砝码放在左边,把药品放在右边称量,则其所配氯化钾溶液的浓度_______。
(实验探究二:测定血液样品中Ca2+的浓度)抽取血样20.00mL经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液与之反应,使草酸转化成CO2 逸出,这时共消耗12.00mL酸性KMnO4溶液 。
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为 :2MnO4-+5H2C2O4+6 H+ =2Mnx++l0CO2↑+8H2O 则式中的x=_______。
(5)经过计算,血液样品中Ca2+的浓度为____mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置不能达到实验目的的是
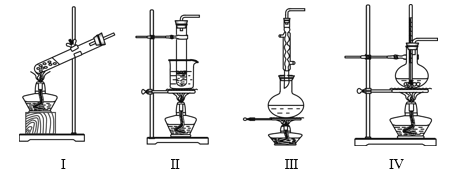
选项 | 实验目的 | 反应试剂及所需物质 | 选择装置 |
A | 制乙酸乙酯 | 无水乙醇、冰醋酸、浓硫酸、碎瓷片 | Ⅰ |
B | 进行银镜实验 | 银氨溶液、乙醛 | Ⅱ |
C | 制葡萄糖酸 | 葡萄糖、3%溴水 | Ⅲ |
D | 制乙烯 | 无水乙醇、浓硫酸、碎瓷片 | Ⅳ |
[注:葡萄糖与3%溴水在55 ℃左右反应]
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
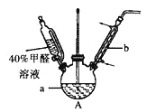
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。
①仪器b的名称是_________,作用为_________。
②能说明甲醛具有还原性的实验现象是______________。
(2)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
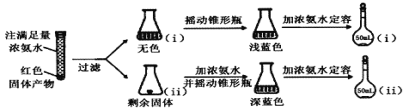
①摇动锥形瓶i的目的是_______。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
2NH3(g),若将1 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数不可能为a的是
A. 2 mol NH3B. 1 mol N2、3 mol H2和2 mol NH3
C. 0.5 mol N2、1.5 mol H2和1 mol NH3D. 0.1 mol N2、0.3 mol H2和1.8 mol NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com