
| A. | 向溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | 碳酸氢镁中加过量氢氧化钠:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O | |
| C. | 向过氧化氢酸性溶液中加入氯化亚铁:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | 明矾溶液中加入过量的氨水A13++3NH3•H20=Al(OH)3↓+3NH4+ |
分析 A.氯气过量,亚铁离子和溴离子完全被氧化;
B.氢氧化钠过量,反应生成氢氧化镁沉淀;
C.双氧水具有强氧化性,将亚铁离子氧化成铁离子;
D.氨水为弱碱,反应生成氢氧化铝沉淀.
解答 解:A.向溴化亚铁溶液中通入过量氯气,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故A正确;
B.碳酸氢镁中加过量氢氧化钠,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O,故B错误;
C.向过氧化氢酸性溶液中加入氯化亚铁,二者发生氧化还原反应,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,故C正确;
D.明矾溶液中加入过量的氨水,铝离子与氨水反应生成氢氧化铝沉淀,反应的离子方程式为:A13++3NH3•H2O=Al(OH)3↓+3NH4+,故D正确;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;B为易错点,注意氢氧化钠过量,反应生成更难溶的氢氧化镁沉淀.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是生产光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | D${\;}_{2}^{16}$O中,质量数之和是质子数之和的两倍 | |
| D. | 石油分馏可获得乙烯、丙烯和丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在一定条件下苯能与氯气发生加成反应 | |
| C. | 在苯中加入酸性高锰酸钾溶液,振荡并静置后下层液体为紫红色 | |
| D. | 在苯中加入溴水,振荡并静置后下层液体为橙色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色化学”的理念是从源头上减少和消除工业产生对环境的污染 | |
| B. | 氢能是清洁能源,工业上电解水法制大量氢气符合节能减排理念 | |
| C. | 如将纳米材料分散到液体分散剂中,该分散系可发生丁达尔现象,由此可推测纳米材料的直径为1~100nm之间 | |
| D. | 将苦卤浓缩、氧化,鼓入热空气或水蒸气提取海水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
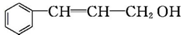 乙:
乙: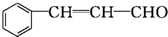
| 分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀硫酸中水解 |
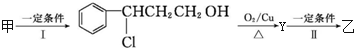
 (注明反应条件).
(注明反应条件).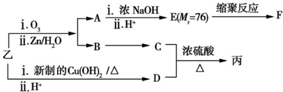
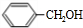 +
+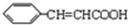 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ 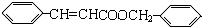 +H2O
+H2O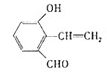 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过电解熔融CD3可以制备C单质 | |
| B. | A和B可以形成BA3、B2A4等酸性化合物 | |
| C. | C的氢氧化物可以溶于B或D的最高价氧化物的水化物 | |
| D. | BA4BO3中只存在非金属元素,只存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH | B. | ZnO | C. | Na2CO3 | D. | Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com