
 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.分析 ①平衡状态的标志可以两个方两去判断,一、是看正逆反应速是否相等,二是各组分的浓度和分数是否随时间的改变而改变;也可以抓住未平衡时是个变量,现在不变说明已经达到平衡状态了,来解决问题;
②用三行式来求平衡时的各组分浓度,然后代入平衡常数表达式求解,要注意代入平衡常数表达式是平衡浓度,平衡常数是温度的函数,温度变平衡常数才变,到底如何变,还要看反应的热效应;
解答 解:①未平衡时是个变量,现在不变说明已经达到平衡状态了,
A.未平衡CO2的体积分数是个变化的量,现在混合气体CO2的体积分数保持不变,说明已经平衡了,故A正确;
B.未平衡时混合气体的平均相对分子质量是个变化的量,现在不随时间的变化而变化,说明已经达平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,向正方向,同时生成0.4mol H2O,也向正方向,不能反映正逆反应之间的关系,故C错误;
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变,不能说明各自的量不再随时间的变化而变化,故C错误;
故选AB,
故答案为:AB;
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始(mol/L) 1 1.5 0 0
变化(mol/L) 0.25 0.75 0.25 0.25
平衡(mol/L) 0.75 0.75 0.25 0.25
所以 K=$\frac{0.25×0.25}{0.75×0.7{5}^{3}}$=0.20,
而平衡常数是温度的函数,只有通过改变温度来改变平衡常数,正反应量放热反应,降低温度,K值变大,变化为1,
故答案为:0.20;C;
点评 本题考查了化学平衡的有关知识,学生要学会三行式在解题中的应用,综合性强,主要是平衡移动原理的分析,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小. ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1>△H2 | B. | △H2=△H1+△H4 | C. | △H3=△H2-△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1m ol | B. | 0.5mol | C. | 0.275mol | D. | 0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )| A. | 到达平衡后,若使用催化剂,C的质量分数增大 | |
| B. | 平衡后,若升高温度,平衡则向逆反应方向移动 | |
| C. | 平衡后增大A的量,有利于提高A的转化率 | |
| D. | 化学方程式中一定是m+n<p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
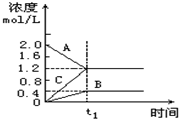 在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )
在一定的温度和容积为l L的密闭容器中投入A、B、C三种气态物质的浓度随时间的变化情况如图所示,下列结论中不正确的是( )| A. | t1时刻之后,若再加入一定量的A,达平衡时A的转化率降低 | |
| B. | t1时刻之后,3v(A)逆=2v(C)正 (v-速率) | |
| C. | t1时刻之后,若升高温度,混合气体的平均摩尔质量增大,则该反应A消耗的方向为吸热反应 | |
| D. | 在温度和容积固定不变的条件下,起始投入1molB、3molC达平衡时A的体积分数为3/7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com