
【题目】工业制硫酸中的一步重要反应是二氧化硫在400~600℃下的催化氧化:2SO2+O2![]() 2SO3。如果反应在密闭容器中进行,下列有关的叙述不正确的是( )
2SO3。如果反应在密闭容器中进行,下列有关的叙述不正确的是( )
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2、O2、SO3将共存于反应体系之中
C.当生成O2的速率与生成SO3的速率相等时达到了平衡
D.为了提高SO2的转化率,可适当地提高O2的浓度
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如图所示.下列说法正确的是( )
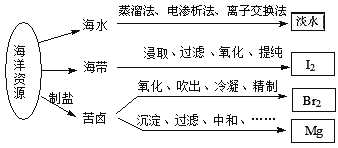
A. 从海水中获取淡水,历史最久的方法是离子交换法
B. 实验室中从海带中获得I2,需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等
C. 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
D. 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈是稀土中丰度最高的元素,其在电子材料、催化剂等方面的应用广泛。现以氟碳铈矿(含CeFCO3、BaO、SiO2等)为原料制备氧化铈(CeO2),并测定其纯度。其工艺流程如下:

已知:①稀土离子易和SO![]() 形成复盐沉淀:
形成复盐沉淀:
Ce2(SO4)3+Na2SO4+nH2O==== Ce2(SO4)3·Na2SO4·nH2O↓(复盐沉淀);
②硫脲:一种有机物,结构简式为![]() ,酸性条件下易被氧化为(SCN2H3)2;
,酸性条件下易被氧化为(SCN2H3)2;
③Ce3+在空气中易被氧化为Ce4+;
回答下列问题:
(1)焙烧时,为了提高焙烧效率,可采取的措施有________________________________________
(2)CeFCO3中Ce元素的化合价为___________,滤渣A的主要成分是_____________
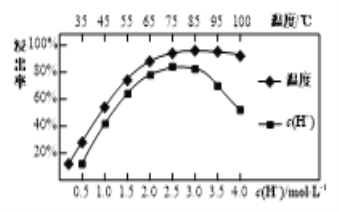
(3)焙烧后加入硫酸浸出,稀土的浸出率和硫酸浓度、温度有关,如图所示,应选择的适宜的条件为___________,硫酸浓度过大时,浸出率减小的原因是__________。
(4)加入硫脲的目的是将Ce4+还原为Ce3+,反应的化学方程式为_________。
(5)步骤③加入盐酸后,通常还需加入H2O2,其主要目的为_________。
(6)步骤④的离子方程式为________________________。
(7)取所得产品CeO2 8.0g,用30 mL高氯酸和20 mL磷酸混合液加热溶解,冷却至室温后,配成250 mL溶液。取25.00 mL溶液用0.2000 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定,已知滴定时发生的反应为Fe2++Ce4+==== Fe3++Ce3+,达到滴定终点时消耗硫酸亚铁铵溶液20.50 mL,则该产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温25 ℃下,向一定量的0.1 mol·L-1的BOH溶液中逐滴滴入稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,pC=-lgc(H+)水]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
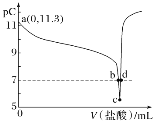
A.BOH为弱碱且Kb的数量级为10-5
B.b点溶液中:c(B+)=c(Cl-)
C.c点溶液中水的电离程度最大
D.c~d点间溶液中:c(BOH)+c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B是两种有刺激气味的气体。试根据下列实验事实填空。
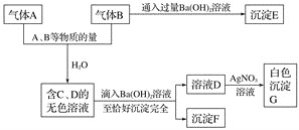
(1)写出A~F各物质的化学式:
A__________、B__________、C__________、D__________、E__________、F__________。
(2)写出A、B跟水反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色环保水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,应用广泛。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,该反应氧化产物是_____(填化学式)。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO、OH、FeO42-、Cl、H2O。
①写出并配平碱性条件下湿法制高铁酸钾的离子反应方程式:________________________________。
②每生成1molFeO42-转移________mol电子;若反应过程中转移了0.3mol电子,则还原产物的物质的量为________mol。
Ⅱ.氧化还原反应在生产生活中应用广泛,思考回答以下问题
已知:2Fe3++2I===2Fe2++I2,2Fe2++Br2===2Fe3++2Br,2Fe2++Cl2===2Fe3++2Cl
(1)含有1mol FeI2和2mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是________。
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,当Br被氧化一半时,c为_______________(用含a、b的代数式表示)。
(3)已知:S2O![]() 具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
具有较强的还原性,实验室可用I-测定测定K2S2O8样品的纯度:有关反应方程式为: I2+2S2O32-→2I+S4O62-,S2O82-+2I→2SO42-+I2,则S2O82-、S4O62-、I2氧化性强弱顺序为:____________。
(4)已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-;向含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如下图所示。
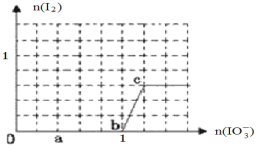
写出a点处还原产物是_______________;b点到c点反应的离子方程式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着原子序数的递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示,下列说法正确的是
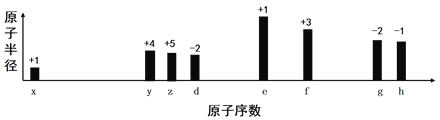
A. z和e的最高价氧化物对应的水化物能相互反应
B. 离子半径:f 3+>e+>d2-
C. g的气态氢化物含有非极性键
D. g的最高价氧化物和水反应生成的化合物是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+![]() O2(g) △H=+484kJ/mol
O2(g) △H=+484kJ/mol
B. 2H2(g)+O2(g)=2H2O(l) △H=-484kJ/mol
C. H2(g)+![]() O2(g)=H2O(l) △H=+242kJ/mol
O2(g)=H2O(l) △H=+242kJ/mol
D. H2O(g)=H2(g)+![]() O2(g) △H=+242kJ/mol
O2(g) △H=+242kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中,甲是电解饱和食盐水,乙是铜的电解精炼,丙是电镀,回答:
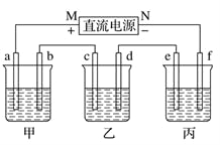
(1)b极上的电极反应式为__,甲电池的总反应化学方程式是__。
(2)在粗铜的电解过程中,图中c电极的材料是__(填“粗铜板”或“纯铜板”);在d电极上发生的电极反应为__;若粗铜中还含有Au、Ag、Fe等杂质,则沉积在电解槽底部(阳极泥)的杂质是__,电解一段时间后,电解液中的金属离子有__。
(3)如果要在铁制品上镀镍(二价金属,相对原子质量59),则f电极的材料是__(填“铁制品”或“镍块”,下同),e电极的材料是__。
(4)若e电极的质量变化118 g,则a电极上产生的气体在标准状况下的体积为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com