
分析 析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.77×1{0}^{-10}}{0.01}$mol/L,AgI溶液中c(Ag+)=$\frac{Ksp(AgI)}{c({I}^{-})}$=$\frac{8.52×1{0}^{-17}}{0.01}$mol/L,Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.12×1{0}^{-12}}{0.01}}$mol/L,c(Ag+)越小,先生成沉淀.
解答 解:向Cl-和l-均为0.010mol/L的溶液中,逐滴加入AgNO3溶液,析出沉淀时,AgCl溶液中c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{1.77×1{0}^{-10}}{0.01}$mol/L=1.77×10-8mol/L;
AgI溶液中c(Ag+)=$\frac{Ksp(AgI)}{c({I}^{-})}$=$\frac{8.52×1{0}^{-17}}{0.01}$mol/L=8.52×10-15mol/L;
所以I-先沉淀,当开始生成AgCl时,溶液中c(Ag+)=1.77×10-8mol/L,则此时c(I-)=$\frac{8.52×1{0}^{-17}}{1.77×1{0}^{-8}}$=4.81×10-9mol/L,
Ag2CrO4溶液中c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.12×1{0}^{-12}}{0.01}}$mol/L=1.6×10-5mol/L;
Cl-和CrO42-均为0.010mol/L的溶液中,逐滴加入AgNO3溶液,Cl-先析出沉淀.
答:I-先沉淀,当开始生成AgCl时,I-的浓度为4.81×10-9mol/L;将“I-”改为“CrO42-”,Cl-先析出沉淀.
点评 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意根据溶解度判断生成沉淀的先后顺序,组成不相似的物质,不能直接根据溶度积判断,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 向水中加入少量固体KHSO4,c(H+)增大,KW不变 | |
| B. | 向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量NH4Cl固体,平衡正向移动,c(H+)降低 | |
| D. | 将水加热,KW增大,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液体积 (mL) | 所耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.2 | 21.32 |
| 3 | 20.00 | 1.3 | 21.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
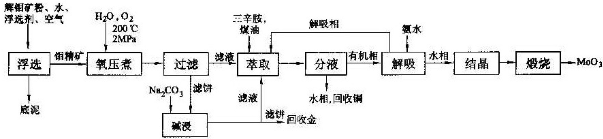
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
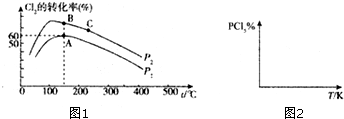
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mo1•L-1的 Ca(ClO)2溶液中含ClO-数目小于2NA | |
| B. | 1 mo1 N2和3 mol H2在密闭容器中充分反应后,容器中含有 N-H键数为6NA | |
| C. | 1 mol乙烯和乙醇气体的混合物完全燃烧,消耗的氧分子数为3NA | |
| D. | 标准状况下,2.24 L35Cl2中含有的中子数为3.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 3:1 | B. | 2:1 | C. | 4:1 | D. | 1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com