
【题目】某核素![]() 的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
的氯化物XCl2 0.95g配成溶液后,需用1mol/L的硝酸银溶液20mL才能把氯离子完全沉淀下来,试计算:
(1)X的质量数为_________。
(2)若X的核内中子数为12,求47.5gXCl2中所含质子的物质的量是________。
【答案】24 23mol
【解析】
(1)利用Cl-+Ag+=AgCl↓来计算Cl-的物质的量,从而得出XCl2的物质的量,再利用M=![]() 计算XCl2的摩尔质量,进而计算X的质量数;
计算XCl2的摩尔质量,进而计算X的质量数;
(2)中子数+质子数=质量数,据此计算X原子质子数,根据n=![]() 计算37gXCl2的物质的量,进而计算所含质子的物质的量。
计算37gXCl2的物质的量,进而计算所含质子的物质的量。
(1)硝酸银的物质的量n(AgNO3)=c·V=1mol/L× 0.02L=0.02mol,根据Cl-+Ag+=AgCl↓可知,则n(Cl-)=n(Ag+)=n(AgNO3)=0.02mol,则n(XCl2)=![]() n(Cl-)=0.01mol,所以XCl2的摩尔质量M(XCl2)=
n(Cl-)=0.01mol,所以XCl2的摩尔质量M(XCl2)=![]() =95g/mol,由于摩尔质量是以g/mol为单位,数值上等于该物质的相对分子质量,所以其相对分子质量为95,则X的相对原子质量为95﹣35.5×2=24,即X的质量数为24;
=95g/mol,由于摩尔质量是以g/mol为单位,数值上等于该物质的相对分子质量,所以其相对分子质量为95,则X的相对原子质量为95﹣35.5×2=24,即X的质量数为24;
(2)根据中子数+质子数=质量数,X的质量数为24,若X的核内中子数为12,则X的质子数为24-12=12,Cl原子的的质子数为17,则47.5gXCl2中所含质子的物质的量n(质子)=![]() ×(12+17×2)=23mol。
×(12+17×2)=23mol。


科目:高中化学 来源: 题型:
【题目】汽车尾气(主要成分为NOx和CO)已成为主要的空气污染物来源之一,有发生光化学烟雾污染的潜在危险。
(1)某小组同学为研究光化学烟雾的形成进行了模拟实验。测得烟雾的主要成分为CxHy(烃)、NO、NO2、O3、PAN (CH3COOONO2),各种物质的相对浓度随时间的变化如右图。根据图中数据,下列推论最不合理的是_____。(填选项序号字母)

a.NO的消失的速率比CxHy快 b.NO生成NO2
c.CxHy及NO2可以生成PAN及O3 d.O3生成PAN
(2)一定条件下,将2 mol NO与2 mol O2置于恒容密闭容器中发生反应2NO(g)+O2(g) ![]() 2NO2(g),下列可判断反应达平衡的是_____。(填选项序号字母)
2NO2(g),下列可判断反应达平衡的是_____。(填选项序号字母)
a.体系压强保持不变 b.混合气体密度保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗2 mol NO同时生成2 mol NO2
(3)高温下N2和O2发生N2(g)+O2(g)![]() 2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
2NO(g)反应,是导致汽车尾气中含有NO的原因之一。
①右图是T1、T2两种不同温度下,一定量的NO发生分解过程中N2的体积分数随时间变化的图像,据此判断反应N2(g)+O2(g)![]() 2NO(g)为_____(填“吸热”或“放热”)反应。
2NO(g)为_____(填“吸热”或“放热”)反应。

②2000℃时,向容积为2 L的密闭容器中充入10 mol N2与5 mol O2,达到平衡后NO的物质的量为2 mol,则此刻反应的平衡常数K=_____。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为_____。

③汽车净化装置里装有含Pd化合物的催化剂,气体在催化剂表面吸附与解吸作用的机理如右图所示。写出其变化的总化学反应方程式:_____。
(4)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2
若16 g CH4还原NO2至N2,共放出热量867 kJ,则ΔH2=_____。若用标准状况下4.48 L CH4还原NO2至N2,共转移的电子总数为_____(阿伏加德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 常温常压,两种气体的密度之比等于摩尔质量之比
B. 在同温同体积下,两种气体的物质的量之比等于压强之比
C. 在标准状况下,两种气体的体积之比等于摩尔质量之比
D. 在同温同压下,同体积的两种气体的质量之比等于摩尔质量之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁矿石(Fe2O3)为起始物,经过一系列反应可以得到Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)写出Fe的原子结构示意图_____________________,O原子核外电子轨道表示式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为__________。如图是SCN与Fe3+形成的一种配离子,画出该配离子中的配位键(以箭头表示)_______。
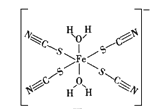
(3)K3[Fe(CN)6]晶体中Fe3+与CN之间的键型为__________,该化学键能够形成的原因是_______。
(4)K3[Fe(CN)5NO]的组成元素中,属于第二周期的元素的第一电离能由小到大的顺序是_____,配合物中原子序数最小的元素与氢元素形成的相对分子质量为92的芳香化合物中,中心原子的杂化轨道类型是_________。
(5)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写出该变化的化学方程式______。
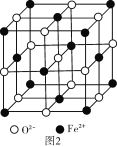
(6)FeO晶胞结构如图2所示,FeO晶体中Fe2+配位数为____,若该晶胞边长为acm,则该晶体密度为___g/cm3(阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明从表中提供的信息中,得出以下几个结论,其中正确的是

A. 热值大的燃料燃烧时放出的热量多
B. 1千克汽油燃烧时放出的热量是4.6×107焦耳
C. 木炭燃烧不充分时其热值会变小
D. 2m3的沼气完全燃烧时放出的热量是3.8×107焦耳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请认真观察下图,然后回答问题:

(1)图中所示反应是_____(填“吸热”或“放热”)反应,该反应的ΔH=______(用含E1、E2的代数式表示)。
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子的百分数增多, 反应速率明显加快,你认为最可能的原因是_________________________________________________________。
(3)甲醇(CH3OH)广泛用作燃料电池的燃料,可由天然气来合成,已知:①2CH4(g)+O2(g)===2CO(g)+4H2(g)ΔH=-71 kJ·mol-1②CO(g)+2H2(g)===CH3OH(l)ΔH=-90.5 kJ·mol-1③CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890 kJ·mol-1,则甲醇的燃烧热为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol某固体A的质量是30g,A的摩尔质量为_________。
(2)在同温同压同体积的条件下,H2与气体B的密度之比是1∶8,则B的相对分子质量为_____。
(3)在25℃ 101kPa的条件下,同质量的CH4和C气体的体积之比是15∶8,则1摩尔C的质量为______。
(4).质量之比为8∶7∶6的三种气体SO2、CO、NO,其分子数之比为_____;氧原子数之比为______;相同条件下的体积之比为_____。
(5)4.8g碳在一定量的氧气中燃烧,反应后生成的气体质量为12.8g。则在标准状况下,生成物CO和CO2的体积比为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com