
| A. | 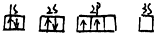 | B. | 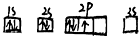 | ||
| C. | 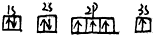 | D. | 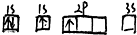 |
分析 遵循洪特规则、泡利不相容原理、能量最低原理的基态原子排布能量最低,以此分析.
A.符合基态原子核外电子排布三原则,能量最低;
B.基态原子的电子总是优先单独占据一个原子轨道,且自旋状态相同;
C.电子处于2p能级时具有的能量比3s能级时具有的能量低;
D.电子处于2s能级时具有的能量比2p能级时具有的能量低.
解答 解:A、能级能量由低到高的顺序为:1s、2s、2p;每个轨道最多只能容纳两个电子,且自旋相反,简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,能量最低,故A正确;
B、2p能级的3个简并轨道(能级相同的轨道)只有被电子逐一自旋平行地占据后,才能容纳第二个电子,不符合能量最低原理,原子处于能量较高的激发态,故B错误;
C、2s能级的能量比3p能量低,电子尽可能占据能量最低的轨道,不符合能量最低原理,原子处于能量较高的激发态,故C错误;
D、2s能级的能量比2p能量低,电子尽可能占据能量最低的轨道,不符合能量最低原理,原子处于能量较高的激发态,故D错误;
故选A.
点评 本题考查基态原子核外电子排布规则,遵循洪特规则、泡利不相容原理、能量最低原理的基态原子排布能量最低,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体分散质粒子较大,不能透过滤纸 | |
| B. | 液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类 | |
| C. | 利用丁达尔效应可以区分溶液和胶体 | |
| D. | 纳米材料分散到液体分散剂中的分散系属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸检测,氨水溶液呈碱性:NH3•H2O=NH4++OH- | |
| B. | 100℃时,测得纯水中c(H+)•c(OH-)=3.8×10-13 H2O(l)?H+(aq)+OH-(aq)△H<0 | |
| C. | FeCl3溶液中通入适量SO2,溶液黄色褪去:Fe3++SO2+2H2O=Fe2++SO42-+4H+ | |
| D. | 用CaSO4治理盐碱地:CaSO4(s)+Na2CO3(aq)?CaCO3(s)+Na2SO4(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂发生还原反应 | B. | 一定有氧元素参与反应 | ||
| C. | 一定有元素化合价升降 | D. | 氧化剂失去电子,化合价升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表第5列是第Ⅴ副族 | |
| B. | 元素周期表中所含元素种类最多的族是第Ⅷ族 | |
| C. | 第ⅠA族的元素就是碱金属元素 | |
| D. | 元素周期表中第4、5、6、7周期为长周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2通入足量氢氧化钠溶液中:CO2+2OH-=CO32-+H2O | |
| B. | 用小苏打治疗胃酸过多:HCO${\;}_{3}^{-}$+OH-=CO2↑+H2O | |
| C. | 将Cl2通入水中:Cl2+H2O=Cl-+2H++ClO- | |
| D. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应,Ba2++OH-+H++SO42-═BaCO4↓+H2O | |
| B. | 实验室用大理石与稀盐酸制取二氧化碳:2H++CO32-═CO2↑+H2O | |
| C. | 金属钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| D. | Cl2与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com