
分析 ①,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,氧化还原反应中遵循得失电子守恒、电荷及原子守恒;
②使湿润的红色石蕊试纸变蓝的气体为氨气,结合元素及电子守恒可知,还生成氮气.
解答 解:①依据题意,反应物为Co2+与肼(N2H4)、碱性条件下存在OH-,生成物为:钴单质,据此得出Co的化合价降低,故N的化合价升高,只能为0价,即氮气,据此得出还有水生成,氧化还原反应中存在得失电子守恒以及元素守恒,故此反应的离子反应方程式为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O,
故答案为:2Co2++N2H4+4OH-=2Co↓+N2↑+4H2O;
②使湿润的红色石蕊试纸变蓝的气体为氨气,即肼分解生成氨气,依据元素守恒得知另外一种产物为氮气,故化学反应方程式为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3,
故答案为:3N2H4$\frac{\underline{催化剂}}{△}$N2+4NH3.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重于学生的分析与应用能力的考查,注意习题中的信息及电子守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3-+Ba2-+2OH-=BaCO3↓+NH3•H2O+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 | |
| D. | 用惰性电极电解氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰和浓盐酸反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| B. | 稀盐酸和硅酸钠溶液反应:SiO32-+2H+═H2SiO3↓ | |
| C. | 碳酸钙和稀盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 铜和氯化铁溶液反应:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水的物质的量浓度等于氢氧化钠溶液 | |
| B. | 将氨水体积稀释10倍,pH<11 | |
| C. | 等体积氨水和氢氧化钠溶液与足量氯化铁溶液反应,氨水产生的沉淀多 | |
| D. | 将等体积的氨水和氢氧化钠用稀盐酸完全中和,消耗盐酸的体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| B. | 在量取液体后,量筒中残留的液体要用蒸馏水洗涤并转入相应容器 | |
| C. | 在测量或监测温度时,温度计水银球不能碰到容器内璧或底部 | |
| D. | 分液漏斗使用前需要检漏,确认不漏水后方可使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中含有的化学键类型为离子键和共价键.
,其中含有的化学键类型为离子键和共价键.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1:1:1 | B. | 1:1:2 | C. | 1:2:3 | D. | 2:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
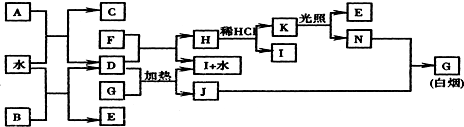
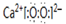 ;K的结构式是H-O-Cl.
;K的结构式是H-O-Cl.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com