
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
分析 (1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是普通漏斗;
(2)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发,据此解答即可;
(3)根据平衡移动原理分析采用边反应边蒸出产物的原因;根据1-溴丁烷和正丁醇的沸点的沸点大小判断;
(4)浓硫酸具有强氧化性,能氧化溴离子为溴单质,易发生消去反应,浓硫酸溶解溶液温度升高易使溴化氢挥发;根据NaHSO3溶液具有还原性,溴单质具有氧化性回答;
(5)从有机混合物中获取有机物,可以采取蒸馏的方法;
(6)依据化学方程式分析1-丁醇、NaBr反应情况,依据化学方程式计算生成的1-溴丁烷质量,依据产率=$\frac{实际产量}{理论产量}$×100%计算得到.
解答 解:(1)普通漏斗主要用于过滤操作,即有晶体析出时,但溴乙烷和一溴丁烷均不是晶体,则无需使用,故答案为:d;
(2)浓硫酸和1-丁醇反应发生副反应消去反应生成烯烃、分子间脱水反应生成醚,稀释后不能发生类似反应减少副产物烯和醚的生成;浓硫酸具有强氧化性能将溴离子氧化为溴单质,稀释浓硫酸后能减少Br2的生成;反应需要溴化氢和1-丁醇反应,浓硫酸溶解溶液温度升高,使溴化氢挥发,稀释后减少HBr的挥发;故答案为:减少副产物烯和醚的生成,防止溴离子被浓硫酸氧化为溴单质;
(3)根据题给信息知,乙醇和溴乙烷的沸点相差较大,采用边反应边蒸出产物的方法,可以使平衡向生成溴乙烷的方向移动,而1-溴丁烷和正丁醇的沸点相差较小,若边反应边蒸馏,会有较多的正丁醇被蒸出,所以不能边反应边蒸出产物,
故答案为:平衡向生成溴乙烷的方向移动;1-溴丁烷和正丁醇的沸点相差不大,正丁醇会随1-溴丁烷同时蒸出;
(4)1-溴丁烷和水不能形成氢键所以不易溶于水,且密度大于水,所以将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层,溴单质和NaHSO3 溶液发生氧化还原反应,可以除去溴单质,故答案为:下层;除去产物中杂质溴;
(5)溴乙烷和1-溴丁烷的沸点相差较大,可以采用蒸馏方法除去,故答案为:蒸馏;
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,依据化学方程式计算判断反应情况:
CH3CH2CH2CH2OH+NaBr+H2SO4$\stackrel{△}{→}$CH3CH2CH2CH2Br+NaHSO4+H2O
74 103
7.4g 10.3g
溴化钠过量,则1-丁醇全部反应生成1-溴丁烷物质的量为0.1mol,质量=0.1mol×137g/mol=13.7g;
蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,产率=$\frac{9.6g}{13.7g}$×100%=70%,故答案为:70%.
点评 本题主要考查了1-溴丁烷的制取实验,混合物分离的实验操作步骤和过程分析判断,明确反应原理是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



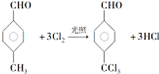 ,反应类型为取代反应
,反应类型为取代反应 +n
+n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(2n-1)H2O
+(2n-1)H2O 的路线流程图:
的路线流程图: 合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

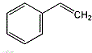 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com