
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol•L-1) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
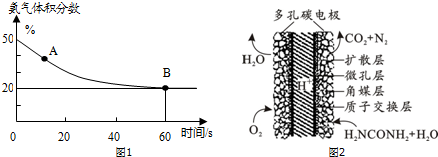
分析 (1)图象分析氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应;
反应物是气体,产物是固体,该反应是熵减小的过程;
②A.因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动;
B.氨基甲酸铵为固体,所以NH3和CO2始终为2:1;
C.因为体积比为2:1的NH3和CO2混合气体充入反应,NH3和CO2又按照2:1的消耗,所以NH3的转化率始终等于CO2的转化率;
D.催化剂只改变速率,不改变平衡移动,由此进行判断;
(3)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳.
解答 解:(1)氨气的体积分数从50%变化为20%后体积分数保持不变,说明B点反应达到平衡状态,A点氨气体积百分含量大于B的氨气体积百分含量,说明反应正向进行达到平衡状态,A点的正反应速率大于B点的正反应速率,故v正(CO2)>v逆(CO2),
故答案为:>;
(2)①根据表中的数据分析:温度越高,则平衡气体的总浓度越大,所以升高温度,平衡逆向移动,正反应反应是放热反应,故△H<0;
反应物是气体,产物是固体,该反应是熵减小的过程,即,△S<0,
故选A;
②A.因为氨基甲酸铵为固体,分离出少量的氨基甲酸铵,平衡不移动,所以反应物的转化率不变,故A错误;
B.平衡时降低体系温度,平衡向放热方向即正反应方向移动,又氨基甲酸铵为固体,所以NH3和CO2始终为2:1,则CO2的体积分数不变,故B错误;
C.因为体积比为2:1的NH3和CO2混合气体充入反应,NH3和CO2又按照2:1的消耗,所以NH3的转化率始终等于CO2的转化率,故C正确;
D.催化剂只改变速率,不改变平衡移动,所以加入有效的催化剂不能够提高氨基甲酸铵的产率,故D错误;
故选C;
(3)尿素燃料电池中尿素再负极上失去电子生成氮气、二氧化碳,负极反应为CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+,
故答案为:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
点评 本题考查化学反应速率、化学平衡的移动原理、弱碱根离子在溶液中的水解平衡的计算应用以及燃料电池负极反应式的书写等知识,综合性较大,难度中等.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
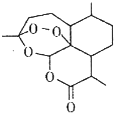 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 能与Cl2发生取代反应 | D. | 能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
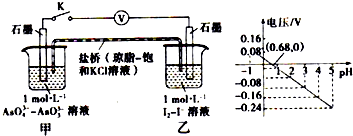 某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )| A. | pH=0.68时,反应处于平衡状态 | |
| B. | 调节pH可以改变反应的方向 | |
| C. | pH>0.68时,负极电极反应式为2I--2e -═I2 | |
| D. | pH=5时,氧化性I2>AsO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | 元素的相关信息 |
| A | 最高价氧化物对应的水化物(甲)能与其气态氢化物(乙)反应生成盐 |
| B | 原子的M电子层上有3个电子 |
| C | 在短周期主族元素中,其原子半径最大 |
| D | 其最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反 应生成D的单质和H2O |
| E | 元素最高正价与最低负价的代数和为6 |
| A. | A的气态氢化物具有还原性,常温下,该氢化物水溶液的pH>7 | |
| B. | C单质在氧气中燃烧后的产物中阴阳离子个数之比为1:2 | |
| C. | 在B和E所形成的化合物中存在离子键 | |
| D. | C与D可形成不同原子或离子个数比的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
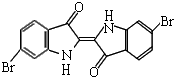 泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )
泰雅紫是古代地中海沿岸出产的一种贵重染料,现知其结构为如图所示的含溴有机化合物,下列说法不正确的是( )| A. | 泰雅紫分子的分子式为C16H8N2Br2O2 | |
| B. | 1mol泰雅紫与H2加成最多需9molH2 | |
| C. | 泰雅紫属于烃的衍生物 | |
| D. | 检验泰雅紫中溴元素可直接加入硝酸银溶液,观察是否有浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3$\stackrel{△}{→}$Al2O3(熔融)$\stackrel{电解}{→}$Al | |
| B. | Cu2(OH)2CO3$\stackrel{盐酸}{→}$CuCl2(aq)$\stackrel{电解}{→}$Cu | |
| C. | SiO2$\stackrel{H_{2}O}{→}$H2SiO3$\stackrel{NaOH(aq)}{→}$Na2SiO3(aq) | |
| D. | CuSO4(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2悬浊液$→_{△}^{葡萄糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
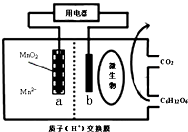
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com