
【题目】H、C、N、F、Al、Ca、Ni、Cu是中学阶段常见的元素,回答下面几个小题
(1)基态Ni的外围电子排布式为
(2)比较C、N、Al的第一电离能(用元素符号表示)
(3)比较Cu、Al、C的最高价氧化物的沸点由高到低顺序为(用化学式表示)
(4)常温下某气态有机物由C、O、H三种元素组成,写出其中C的杂化方式
(5)Ni为电池中常见的材料,以Al和NiOOH为电极,NaOH为电解液组成电池,放电时NiOOH转化为Ni(OH)2写出电池的总反应
(6)Ca和F形成的某离子晶体结构如图所示,Ca2+的配位数为 . 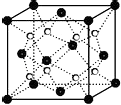
【答案】
(1)3d84s2
(2)N>C>Al
(3)Al2O3>CuO>CO2
(4)sp2杂化
(5)Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2
(6)8
【解析】解:(1)Ni是28号元素,外围电子排布式为3d84s2 , 所以答案是:3d84s2;(2)同周期元素从左到右元素的第一电离能逐渐增大,则N>C>Al,所以答案是:N>C>Al;(3)Cu、Al、C的最高价氧化物分别为氧化铜、氧化铝、二氧化碳,二氧化碳为分子晶体,氧化铜、氧化铝都为离子晶体,氧化铝中铝离子半径较小,电荷较多,则氧化铝晶格能较大,沸点较高,应为Al2O3>CuO>CO2 , 所以答案是:Al2O3>CuO>CO2;(4)气态有机物由C、O、H三种元素组成,为HCHO,C形成3个δ键,没有孤对电子,为sp2杂化,所以答案是:sp2杂化;(5)NiOOH转化为Ni(OH)2 , Mi元素化合价降低,被还原,为正极反应;碱性条件下Al被氧化生成NaAlO2 , 则反应的方程式为Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2 , 所以答案是:Al+3NiOOH+NaOH+H2O=3Ni(OH)2+NaAlO2;(6)Ca和F形成的离子化合物为CaF2 , 由晶胞可知Ca2+位于定点,每个晶胞中有1个F﹣与Ca2+距离最近,而定点为8个晶胞共有,则配位数为8,所以答案是:8.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X,Y,Z的物质的量的变化如图所示.则下列有关推断正确的是 ( ) 
A.该反应的化学方程式为3X+2Y2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面小题:
(1)H2O2水溶液给称双氧水,医疗上利用它有杀菌消毒作用来清洗伤口,对下列A﹣C涉及H2O2的反应,填写下列空白:A、H2O2+Cl2═HCl+O2
B、H2O2+2I﹣+2H+═I2+2H2O
C、2H2O2 ![]() 2H2O+O2
2H2O+O2
D、CaO+H2O=Ca(OH)2
①H2O2仅体现氧化性的反应是(填代号,下同)
②H2O2既有氧化性又有还原性的是
③H2O2仅体现还原性的是
④H2O既无氧化性又无还原性的是
(2)已知CuO具有氧化性,能够与NH3反应生成两种单质和H2O,请写出在加热条件下CuO与NH3反应的化学方程式
(3)在一定条件下,RO ![]() 与Cl2反应如下:RO
与Cl2反应如下:RO ![]() +Cl2+2OH═RO
+Cl2+2OH═RO ![]() +2Cl+H2O由以上反应可知上述过程中RO
+2Cl+H2O由以上反应可知上述过程中RO ![]() 被(填“氧化”或“还原”),RO
被(填“氧化”或“还原”),RO ![]() 元素R的化合价是 .
元素R的化合价是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)写出表示含有8个质子,10个中子的原子的化学符号: .
(2)根据下列微粒回答问题: ![]() H、
H、 ![]() H、
H、 ![]() H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
H、14C、14N、16O、35Cl2、37Cl2 . ①以上8种微粒共有种核素,共种元素.
②互为同位素的是 .
③质量数相等的是和 , 中子数相等的是和 .
(3)相同物质的量的14CO2与S18O2的质量之比为;中子数之比为;电子数之比为 .
(4)铷和另一种碱金属形成的合金7.8g与足量的水反应后,产生0.2g氢气,则此合金中另一碱金属可能是: . (铷的相对原子量取85.5)
(5)质量相同的H2O和D2O与足量钠反应,放出的气体在标况下的体积之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类在一定条件下都可以水解
B.除去油脂中的少量水分,既可以用无水硫酸钠也可以用碱石灰
C.酒中存在的某些微生物可以使部分乙醇发酵,氧化为碳酸,酒就有了酸味
D.氨基酸分子中含有—COOH和—NH2二种原子团,氨基酸分子之间能相互形成复杂的多肽化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是
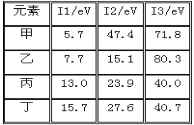
A. 甲的金属性比乙弱
B. 乙的化合价为+1价
C. 丙一定为非金属元素
D. 丁一定是金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com