
| A、在元素周期表金属与非金属分界线附近能找到制半导体材料的元素 |
| B、离子键、共价键、氢键都是化学键 |
| C、元素周期律是元素原子核外电子排布周期性变化的必然结果 |
| D、卤族单质,随着相对分子量的增大,分子间作用力增强,熔沸点也相应升高 |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
| A、CuFeS2既是氧化剂又是还原剂,硫元素既被氧化又被还原 |
| B、每生成1mol SO2转移6mol电子 |
| C、SO2既是氧化产物又是还原产物,FeS只是还原产物 |
| D、每转移1.2 mol电子,有0.3 mol氧气被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol乙烯与乙醇的混合物在氧气中充分燃烧,消耗氧气的分子数为一定为3NA |
| B、28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、硫酸氢铵溶液中加入少量氢氧化钠溶液:NH4++OH-═NH3↑+H2O |
| C、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| D、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++MnO4-═5SO42-+Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
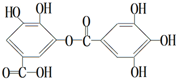
| A、该化合物的分子式为C14H10O10 |
| B、该分子中的所有碳原子一定在同一平面上 |
| C、遇FeCl3溶液显紫色因为该物质与苯酚属于同系物 |
| D、该物质在酸性条件下水解,产物只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、29:8:13 |
| B、22:1:14 |
| C、13:8:29 |
| D、26:15:57 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫酸钡沉淀中加入浓碳酸钠溶液充分搅拌后,取沉淀(洗净)放入盐酸中有气泡产生,说明Ksp(BaCO3)<Ksp(BaSO4) |
| B、将某无色气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 |
| C、取少许某溶液并滴加数滴硫氰化钾溶液,无明显现象;再另取少许该原溶液,先滴加少量新制氯水,再滴加数滴硫氰化钾溶液,溶液变血红色,则原溶液中一定含Fe2+ |
| D、在淀粉溶液中加入稀硫酸并加热片刻再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯与溴蒸气在光照条件下反应主要生成邻溴甲苯和对溴甲苯 |
| B、苯在合适条件下催化加氢可生成环己烷 |
| C、丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
| D、苯与浓硝酸、浓硫酸共热并保持50℃-60℃反应生成硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁原子由基态转化成激发态,这一过程中吸收能量 |
| B、镁原子由激发态转化成基态,这一过程中释放能量 |
| C、镁原子由激发态转化成基态,这一过程叫做电子跃迁 |
| D、转化后镁原子与硅原子电子层结构相同,化学性质相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com