
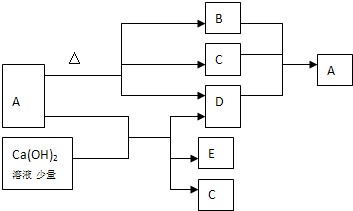


科目:高中化学 来源: 题型:
| A、稀硫酸与氢氧化钾溶液反应 |
| B、氢氧化钡晶体与氯化铵晶体研磨搅拌的反应 |
| C、锌与稀硫酸的反应 |
| D、生石灰变成熟石灰的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
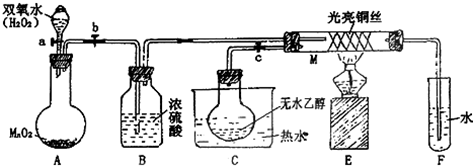
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
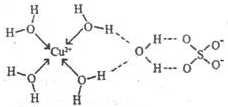 第四周期元素的单质及化合物在工农业生产中应用广泛.
第四周期元素的单质及化合物在工农业生产中应用广泛.| 元素 | Mn | Fe | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
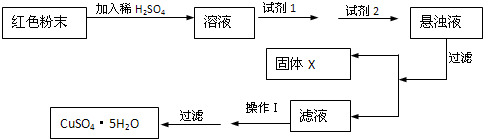
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在有盐桥构成的铜-锌-稀硫酸原电池中,盐桥中的阳离子移向电池的锌极 |
| B、化学平衡的建立与途径无关,可以从正反应方向建立,也可以从逆反应方向建立 |
| C、可以借助分光度计采用比色的方法测定某反应的化学反应速率 |
| D、在FeCl3与过量的KI溶液充分反应后的溶液用CCl4萃取后,往上层溶液中加入几滴KSCN溶液,溶液出现血红色,说明该化学反应存在限度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com