


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
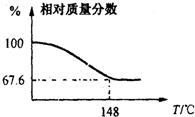 (2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.
(2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.查看答案和解析>>
科目:高中化学 来源: 题型:

| A、峰值最高的过渡元素在周期表中的位置是第四周期第Ⅷ族 | B、上述元素分析图中,同一周期的两种主族元素可形成1:1型离子化合物只有一种,其电子式为Na+ | C、氯比硫的非金属性强的依据之一是HCl比H2S稳定 | D、工业上常用电解氧化铝的方法制备铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com