
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上___ (填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上____ (填“有”或“没有”)气泡产生。
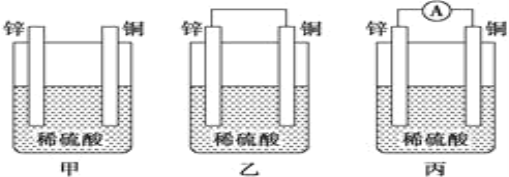
(2)乙、丙装置是将_____能转化为____能的装置,人们把它叫做________。
Ⅱ.将质量相等的锌片和铜片用导线相连,并浸入500 mL硫酸铜溶液中构成如图所示的装置。

(1)该装置中总反应的离子方程式为____________,铜片周围溶液会出现_________的现象。
(2)若2 min后测得锌片质量减少1.3 g,则导线中流过的电子为________mol。
【答案】没有 有 化学 电 原电池 Zn+Cu2+=Zn2++Cu 颜色变浅 0.04
【解析】
根据原电池原理分析装置是否构成原电池,描述电极发生的现象;根据电极反应式计算电子转移数目。
Ⅰ.(1)平行地插入一块铜片,如图甲所示并未形成原电池,铜和稀硫酸不反应,所以铜片上没有气泡产生;用导线把锌片和铜片连接起来,如图乙所示,形成了原电池,铜片作正极,正极反应式为:2H++2e-=H2↑,所以铜片上有气泡产生;
(2)如图所示,乙、丙装置属于原电池,所以是将化学能转变为电能的装置,人们把它叫做原电池;
Ⅱ.(1)该装置中总反应为锌和硫酸铜溶液的反应,离子方程式为Zn+Cu2+=Zn2++Cu;铜片作正极,发生的电极反应为:Cu2++2e-=Cu,所以铜片周围溶液会出现颜色变浅的现象;
(2)n(e-)=2n(Zn)=2×![]() =0.04mol。
=0.04mol。


科目:高中化学 来源: 题型:
【题目】从石油和煤中提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12:1,B的相对分子质量为78。回答下列问题:
(1)A的结构简式_______________,B的结构简式_________________;
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:_____________;反应类型:___________。
(3)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式: ______________________ 反应类型:___________。
(4)等质量的A、B完全燃烧时消耗O2的物质的量________(填A>B、A<B或A=B”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题。
(1)有下列六种有机物:①蛋白质溶液 ②油脂 ③涤纶 ④纤维素 ⑤淀粉 ⑥丙氨酸,请将相应的序号填入空格内。
能加强肠胃蠕动的是_________;加入浓硝酸会有白色沉淀产生,加热后沉淀变黄的可能是_________;通常用于制肥皂的是___________;属于合成纤维的是___________;能水解生成葡萄糖供机体利用,还可用于酿制食醋、酒的是___________;能与酸、碱反应生成盐且不属于高分子化合物的是_______。
(2)![]() 的名称是(用系统命名法命名)_____________;1,2-二甲苯的结构简式是___________________________。
的名称是(用系统命名法命名)_____________;1,2-二甲苯的结构简式是___________________________。
(3)聚合物 单体的结构简式是________________;
单体的结构简式是________________;
 单体的结构简式是________________。
单体的结构简式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

回答下列问题:
(1)用于文物年代测定的元素,其核素符号为_________。元素z在周期表中的位置是____________。
(2)元素d、e、f、g原子的简单离子半径由大到小的顺序为_________(用离子符号表示)。
(3)元素f的单质与元素e的最高价氧化物对应的水化物反应的化学方程式为___________________。
(4)元素h单质的氧化性强于元素g单质的氧化性的事实是___________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
在一个密闭容器中进行,下列措施可以使反应速率增大的是( )
①增加少量![]() ②升高温度③体积不变,再通入
②升高温度③体积不变,再通入![]() ④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
④缩小体积增大压强⑤体积不变,再通入He⑥压强不变,再通入He
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处于另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。D的周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是__________________ (用元素符号填写),其中D的最高价氧化物是________氧化物(填“酸性”“碱性”或“两性”)。
(2)乙物质中存在的化学键类型是________。
(3)化合物乙的电子式为________。
(4)写出C与D分别对应的最高价氧化物的水化物反应的离子方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验时,不慎把浓硫酸洒在皮肤上,正确的处理方法是( )
A.用水冲洗,再涂上硼酸溶液
B.用氢氧化钠溶液中和,再用水冲洗
C.用布擦去硫酸后,用稀氢氧化钠溶液冲洗
D.用布擦去硫酸后,用大量水冲洗,再用3%~5%的碳酸氢钠溶液涂抹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是最好的抵抗疟疾的药物,可从黄花蒿茎叶中提取,它是无色针状晶体,可溶于乙醇、乙醚等有机溶剂,难溶于水。常见的提取方法如下。

(1)操作I、II中,不会用到的装置是________(填序号)。

(2)向干燥、破碎后的黄花蒿中加入乙醚的作用是________。
(3)操作III的目的是_________。
(4)某同学发现青蒿素可以使湿润的淀粉碘化钾试纸变蓝,依据此现象在其键线式上圈出对应的基团_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向300mL2.0 mol/L盐酸中加入几小块大理石,产生气体的体积随时间的变化曲线如右图所示(气体体积在标准状况下测定)试回答下列问题:

(1)若以反应中消耗的HCl表示反应速率,设OE段的反应速率为v1,EF段的反应速率为v2,FG段的反应速率为v3,则v1、v2、v3从大到小的顺序为_______,其中造成v1和v2大小关系的主要原因是__________。
(2)为了减缓上述反应的速率,欲向该溶液中加入下列物质,你认为可行的是_____(填编号)
A.浓硫酸 B.Na2CO3 C.蒸馏水 D.浓盐酸
(3)若反应过程中溶液体积的变化忽略不计,用盐酸表示的化学反应速率v(HCl)=________mol/(Lmin)。.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com