
【题目】漂白粉在工业上有着重要的应用,某同学利用下列仪器在实验室进行制备漂白粉的实验。请回答下列问题:
I.氯气的制备
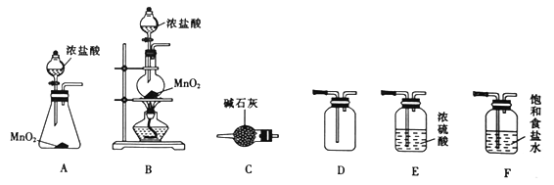
(1)装置C的名称为_______________。
(2)实验室选择上图中的装置制备并收集干燥氯气,其连接顺序为_______________(填字母)。
(3)装置F的作用为___________________________。
Ⅱ.漂白粉的制备
(4)已知:氯气和石灰乳在反应的过程中会放热,当温度较高时会生成Ca(ClO3)2。为了制得纯度较高的漂白粉并提高产率,实验中可采取的措施有__________________、____________________(不改变石灰乳的浓度和体积)。
(5)若将100 mL 12.0 molL-1盐酸与3.48 g MnO2反应制得的氯气全部通入足量的石灰乳中,理论上最多可制得Ca(ClO)2_________g。
【答案】 干燥管 BFEDC 除去Cl2中混有的HCl杂质 缓慢通入氯气 充分冷却反应装置(其他合理答案也给分) 2. 86
【解析】(1)根据图示,装置C为干燥管,故答案为:干燥管;
(2)收集一瓶干燥的氯气,先制取氯气B(二氧化锰与浓盐酸反应需要加热),洗气装置导气管需要长进短出,利用饱和氯化钠溶液吸收氯气中的氯化氢气体,利用浓硫酸除去氯气中的水蒸气,氯气密度大于空气,需用向上排空气法收集,氯气有毒需进行尾气吸收,所以其连接顺序为:BFEDC,故答案为:BFEDC;
(3)根据上述分析,装置F是用来除去Cl2中混有的HC1杂质,故答案为:除去Cl2中混有的HC1杂质;
(4)氯气和石灰乳在反应的过程中会放热,当温度较高时会生成Ca(ClO3)2。为了制得纯度较高的漂白粉并提高产率,实验中可采取的措施有缓慢通入氯气、充分冷却反应装置等,故答案为:缓慢通入氯气、充分冷却反应装置等;
(5)3.48 g MnO2的物质的量为![]() =0.04mol,100 mL 12.0 molL-1盐酸中含有氯化氢的物质的量为1.2mol,根据MnO2+4HCl(浓)
=0.04mol,100 mL 12.0 molL-1盐酸中含有氯化氢的物质的量为1.2mol,根据MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,盐酸过量;足量的浓盐酸与0.04molMnO2制备氯气,并将所得氯气与过量的石灰乳反应,得到定量关系:
MnCl2+Cl2↑+2H2O,盐酸过量;足量的浓盐酸与0.04molMnO2制备氯气,并将所得氯气与过量的石灰乳反应,得到定量关系:
2MnO2~~~Ca(ClO)2
21
0.04mol 0.02mol
所以理论上最多可制得Ca(ClO)2 质量=0.02mol×143g/mol=2.86g,故答案为:2.86。


科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO![]() ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A. Cl-、Br-、CrO![]() B. Br-、Cl-、CrO
B. Br-、Cl-、CrO![]()
C. CrO![]() 、Br-、Cl- D. Br-、CrO
、Br-、Cl- D. Br-、CrO![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
实验编号 | ① | ② | ③ |
盐酸体积/L | 50 | 50 | 50 |
m(混合物)/g | 9.2 | 26.56 | 36.8 |
V(CO2)(标准状况)/L | 2.24 | 4.48 | 4.48 |
分析表中数据,下列说法中不正确的是( )
A. 由①②可知:①中的盐酸过量
B. 由②③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经完全反应
C. 所用盐酸的物质的量浓度为0.4 mol·L-1
D. 该混合物中NaHCO3的物质的量分数为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓HNO3(其密度为1.4g/mL)配制240mL0.50mol/L稀HNO3,若实验仪器有:A.10mL量筒 B.50mL量筒 C.托盘天平 D.玻璃棒 E.100mL容量瓶 F.250mL容量瓶 G.500mL容量瓶 H.胶头滴管 I.200mL烧杯
(1)此浓硝酸的物质的量浓度为_______mol/L。
(2)应量取63%的浓硝酸____mL,应选用____ (填仪器的字母编号)。
(3)实验时还需选用的仪器有D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)_____。
①量取浓硝酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(5)容避瓶足专门用来配制一定体积一定浓度的溶液的仪器,以下有关容量瓶的叙述正确的有__________。
A.容量瓶上标有压强、温度、刻线
B.容量瓶不能长时间贮存试剂
C.为使实验更准确,容量瓶洗净后最好用欲配制的溶液润洗
D.用容量瓶配制溶液,容量瓶必须是干燥的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某食品包装袋的说明,从表中的配料中分别选出一种物质填在相应的横线上。
品名 | X X X |
配料 | 鲜鸡蛋、精面粉、白砂糖、精练植物油、奶油、奶粉、食盐、柠檬汁等 |
(1)富含蛋白质的是________________; (2)富含糖类的是________________;
(3)富含油脂的是__________________; (4)富含维生素的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是有机金属化学中的常用配体,合成F的一种路线如下:

已知:
①A的核磁共振氢谱为三组峰,且峰面积之比为2:1:3; C的核磁共振氢谱为单峰。
②两分子羰基化合物在一定条件下可以发生下列反应:
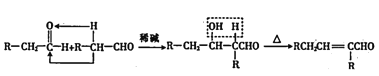
回答下列问题:
(1)A的化学名称是_______。
(2)由A生成B和E生成F的反应类型分别是_____、_______。
(3)B的结构简式为________。
(4)C与D反应生成E的化学方程式为________________。
(5)一定条件下,D与氢气加成后的产物与G互为同系物,且G的分子式为C8H10O。G的同分异构体中,可与FeCl3溶液发生显色反应、核磁共振氢谱为4组峰,且峰面积之比为 6:2:1:1的结构简式为_______、________。
(6)写出以乙醇为原料(其他无机试剂任选)制备化合物CH3CH=CHCHO的合成路线_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.红磷和白磷互为同位素
B.丁烯和丙烯互为同素异形体
C.CH3CH2CH2CH3与CH(CH3)3互为同分异构体
D.16O和18O互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度能加快化学反应速率的主要原因是
A. 增加活化分子百分数 B. 降低活化分子的能量
C. 活化分子能量明显增加 D. 降低反应所需的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中含Cl-浓度最大的是( )
A. 10m1,0.1mol·L-1的AlC13溶液
B. 20m1,0.1mo1·L-1的CaC12溶液
C. 30m1,0.2mo1·L-1的KC1溶液
D. 100m1,0.25mo1·L-1的NaC1溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com