
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
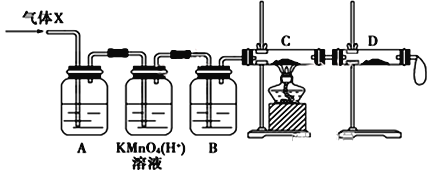
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
【答案】H2 Zn+2H2SO4(浓)![]() ZnSO4 +SO2↑+2H2O Zn+2H2SO4=ZnSO4 +H2↑ 4.48L 除去二氧化硫气体 浓硫酸 CuO C中黑色粉末变为红色,D中的白色固体变为蓝色
ZnSO4 +SO2↑+2H2O Zn+2H2SO4=ZnSO4 +H2↑ 4.48L 除去二氧化硫气体 浓硫酸 CuO C中黑色粉末变为红色,D中的白色固体变为蓝色
【解析】
(1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌,二氧化硫和水,锌和稀硫酸反应生成硫酸锌和氢气,据此书写化学方程式;
(2)硫酸完全反应,发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,Zn+H2SO4=ZnSO4+H2↑,结合方程式计算;
(3)证明气体中含有氢气,酸性高锰酸钾溶液目的吸收生成的二氧化硫气体,则B装置中加浓硫酸吸收气体表面的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D无水硫酸铜检验水,若变蓝色则C装置反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2,据此进行分析.
(1)浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,所以气体杂质含有氢气;锌和浓硫酸反应生成硫酸锌,二氧化硫和水,故对应的化学方程式为Zn+2H2SO4(浓)![]() ZnSO4 +SO2↑+2H2O,锌和稀硫酸反应生成硫酸锌和氢气,
ZnSO4 +SO2↑+2H2O,锌和稀硫酸反应生成硫酸锌和氢气,
故对应的化学方程式为Zn+2H2SO4=ZnSO4 +H2↑;
(2)一定质量的Zn与87.5mL 16.0mol/L的H2SO4的浓溶液充分反应,反应后称量剩余锌发现质量减少了78.0g,则参加反应Zn的物质的量为1.2mol,H2SO4的物质的量为0.0875L×16mol/L=1.4mol;由于硫酸都没有剩余,设与浓硫酸反应的Zn为xmol,与稀硫酸反应的Zn为ymol,则:在Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O中参加反应的H2SO4为2xmol、生成的SO2为xmol,在Zn+H2SO4=ZnSO4+H2↑中参加反应的H2SO4为ymol,生成的H2为ymol;由题意可知:x+y=1.2、2x+y=1.4,解得x=0.2,y=1.0;
故产生SO2体积(标准状况下)=0.2mol×22.4L/mol=4.48L;
(3)证明气体中含有氢气,酸性高锰酸钾溶液目的吸收生成的二氧化硫气体,则B装置中加浓硫酸吸收气体表面的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D无水硫酸铜检验水,若变蓝色则C装置反应生成水,根据元素守恒且该气体具有还原性,则X气体为H2;
①由以上分析得,酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸;
②由以上分析得,装置C中所装药品为CuO;可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色。


科目:高中化学 来源: 题型:
【题目】某红色固体粉末可能是Fe2O3、Cu2O或二者混合物,为探究其组成,称取mg该固体粉末样品,用足量的稀H2SO4充分反应后,称得固体质量为ag。
已知:Cu2O+2H+ = Cu+Cu2++H2O
(1)若a=____________(用含m的最简式表示),则红色固体粉末为纯净物;
(2)若a=m/9,则红色固体粉末中Fe2O3的物质的量为____________mol(用含m的最简式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
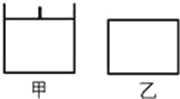
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是

已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为SO2的是_________(填选项序号)。
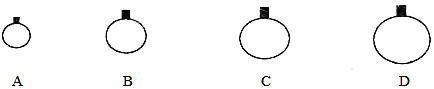
(2)在标准状况下,2.24L由N2、N2O组成的混合气体中含有的氮元素的质量约为_______。
(3)在0.1L由KCl、K2SO4、ZnSO4形成的某植物营养液中,c(K+)=0.7molL﹣1,c(Zn2+)=0.1molL﹣1,c(Cl﹣)=0.3molL﹣1,向混合溶液中滴加足量的BaCl2溶液后产生沉淀的物质的量为_________。
(4)0.3mol的甲烷与_________g氨气中所含氢原子数相等。
(5)在同温同压下,2g二氧化碳的体积为120ml,而2gA气体的体积为165ml,则气体A的摩尔质量_________________;
(6)标准状况下,11.2L二氧化碳和一氧化碳混合气体的质量为18g,则其中二氧化碳的质量为_________,一氧化碳的体积为_________。
(7)氯气(Cl2)、重铬酸钾(K2Cr2O7)是常用的氧化剂。
①硫代硫酸钠(Na2S2O3)被称为“养鱼宝”,可降低水中的氯气对鱼的危害。已知25.0mL0.100molL﹣1 Na2S2O3溶液恰好把标准状况下224mL的Cl2完全转化为Cl﹣,则S2O32﹣将转化成____________。
A.S2﹣ B.S C.SO32﹣ D.SO42﹣
②实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7+14HCl(浓)=3Cl2↑+2CrCl3+2KCl+7H2O,若反应中转移0.6mole﹣,则被氧化的HCl的物质的量为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在150℃时碳酸铵可以受热完全分解,(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
2NH3↑ + H2O↑ + CO2↑,则其完全分解后所产生的气态混合物的密度是相同条件下氢气密度的几倍
A. 96倍 B. 48倍 C. 12倍 D. 32倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法适合实验室制取氨气的是( )
A.N2和H2催化加热制取氨气
B.加热NH4Cl制取氨气
C.将浓氨水加入到碱石灰固体中
D.将NH4Cl溶液和NaOH溶液混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述中,正确的是( )
A. 含20.0gNaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D. 已知石墨转化为金刚石为吸热,那么石墨比金刚石稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com