
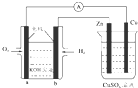
| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
分析 电子由b极沿导线流向锌,则左边装置是氢氧燃料电池,右边装置是电解池,b是原电池负极,a是原电池正极,负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应,锌电极是电解池阴极,铜电极是电解池阳极,实际上右边装置是电镀铜.
解答 解:A.根据电子流向及燃料电池知,a是原电池正极,则铜电极是电解池阳极,故A错误;
B.根据电子流向及燃料电池知,b电极是原电池负极,则锌电极是电解池阴极,阴极上铜离子得电子析出铜,所以锌电极质量增加,故B错误;
C.a极是氧气得到电子,反应的电极反应式为:O2+4e-+2H2O═4OH-,故C正确;
D.根据转移电子守恒知,当铜极的质量变化为32g时,b极上消耗的氢气的物质的量=$\frac{32g}{64g/mol}$=0.5mol,因为温度和压强未知,无法判断压强的体积,故D错误;
故选C.
点评 本题考查原电池和电解池原理,明确电极和电子流向的关系是解本题关键,易错选项是D,有关气体体积的计算要注意温度和压强,为易错点.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学式为C12H18ON2Cl2 | |
| B. | 可以发生取代、加成、水解、酯化、消去反应 | |
| C. | 属于芳香族化合物 | |
| D. | 遇FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.010 mol/( L•s) | B. | v(O2)=0.001 mol/( L•s) | ||
| C. | v(NO)=0.001 mol/( L•s) | D. | v(H2O)=0.045 mol/( L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
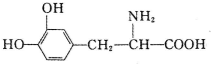
| A. | 常温下,不溶于水 | B. | 既可与酸反应,又可与碱反应 | ||
| C. | 遇FeCl3溶液无变化 | D. | 与溴水混合,溴水褪色,溶液分两层 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com