
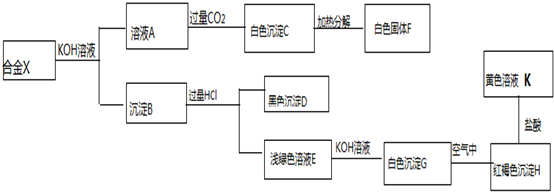
| A. | 该固体中一定含有NH4+、CO32-、SO42-、Na+ | |
| B. | 该固体中一定没有Cu2+、Cl-、Na+ | |
| C. | 该固体中只含有NH4+、CO32-、SO42-、Cl- | |
| D. | 根据以上实验,无法确定该固体中有Na+ |
分析 (1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀,说明沉淀部分溶于盐酸,一定含有CO32-、SO42-,一定不含Cu2+;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol.
据此回答.
解答 解:(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.63g,在沉淀中加入过量稀盐酸,仍有4.66g沉淀,是硫酸钡沉淀0.02mol,沉淀部分溶于盐酸,一定含有CO32-、SO42-,一定不含Cu2+,n(SO42-)=0.02mol,碳酸钡沉淀是6.63g-4.66g=1.97g,物质的量是0.01mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气0.672L即0.03mol(标准状况),所以含有铵根离子0.03mol.
根据电荷守恒,所以一定含有钠离子,其物质的量是:0.02mol×2+0.01mol×2-0.03mol=0.03mol;
A、该固体中一定含有NH4+、CO32-、SO42-、Na+,故A正确;
B、该固体中一定没有Cu2+、故B错误;
C、该固体中一定含有NH4+、CO32-、SO42-、Na+,其余的无法判断,故C错误;
D、根据以上实验,确定该固体中一定有Na+,故D错误.
故选A.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握电荷守恒在离子推断中的应用方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
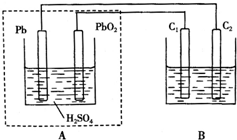 用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )
用铅蓄电池作电源电解某溶液100mL.已知该溶液中含SO2、KI,其物质的量浓度均为0.1mol/L,如图所示(C1、C2为石墨电极),下列说法正确的是( )| A. | 铅蓄电池工作一段时间后A溶液的pH变小 | |
| B. | 当B烧杯中I-的浓度降为0.05mol/L时,消耗A中的H2SO4的物质的量为0.025mol | |
| C. | 当C1、C2两极均产生气体时,应有至少3.6×1022个电子从电路中流过 | |
| D. | 铅蓄电池工作时负极电极反应式为:PbO2-2e-+H2SO4═PbSO4+2H2O+SO${\;}_{4}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 反应物和生成物浓度不再发生变化 | ||
| C. | 反应体系中混合物的组成保持不变 | D. | 正、逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
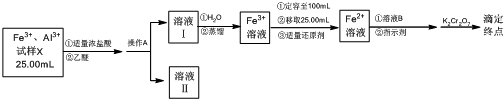
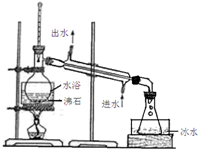
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
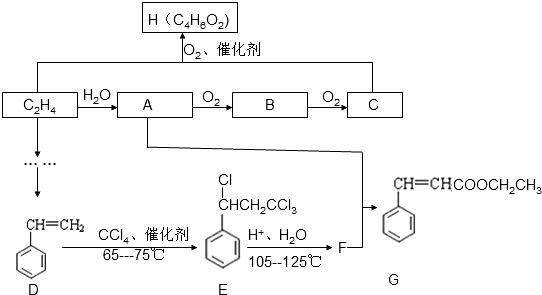
 是G的一种同分异构体
是G的一种同分异构体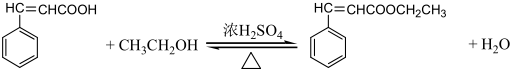 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁溶液腐蚀铜板:Cu+Fe3+═Cu2++Fe2+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ | |
| D. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体, | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com