
【题目】下列反应中,Na2O2只表现强氧化性的是
A. 2Na2O2 + 2CO22Na2CO3 + O2
B. Na2O2 + MnO2 =Na2MnO4
C. 5Na2O2 + 2MnO![]() + 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
+ 16H+ = 10Na+ + 2Mn2+ + 5O2↑ + 8H2O
D. 2Na2O2 + 2H2SO4 = 2Na2SO4 +2H2O + O2↑
【答案】B
【解析】试题分析:A、反应2Na2O2+2CO2=2Na2CO3+O2中,过氧化钠中氧元素的化合价是-1价,碳酸钠中氧元素的化合价是-2价,氧气中氧元素的化合价是0价,所以该反应过氧化钠中既有氧元素化合价升高也有化合价降低,过氧化钠既表现氧化性也表现还原性,故A错误;B、反应Na2O2+MnO2=Na2MnO4中,过氧化钠中氧元素得电子化合价降低,锰元素失电子化合价升高,过氧化钠作氧化剂,二氧化锰作还原剂,所以过氧化钠表现强氧化性,故B正确;C、反应5Na2O2+2MnO4-+16H+=10Na++2Mn2++5O2↑+8H2O中,过氧化钠中氧元素失电子化合价升高,锰元素得电子化合价降低,所以过氧化钠只作还原剂表现还原性,故C错误;D、反应2Na2O2+2H2SO4=2Na2SO4+2H2O+O2↑中,过氧化钠中氧元素既有得电子化合价降低的,也有失电子化合价升高的,所以过氧化钠既表现氧化性又表现还原性,故D错误;故选B。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】现有一可导热体积固定的密闭容器A,和一可导热容积可变的容器B.关闭K2 , 将等量且少量的NO2通过K1、K3分别充入A、B中,反应起始时,A、B的体积相同.(已知:2NO2N2O4;△H<0) 
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VAVB . (填“>”、“<”、“=”);若打开活塞K2 , 气球B将(填:变大、变小、不变).
(2)若在A、B中再充入与初始量相等的NO2 , 则达到平衡时,NO2的转化率αA将(填增大或减小、不变);若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 , B中NO2的转化率将(填:变大、变小、不变).
(3)室温下,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,中的颜色较深.
(4)若在容器A中充入4.6g的NO2 , 达到平衡后容器内混合气体的平均相对分子质量为57.5,则平衡时N2O4的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置测定FeO和Fe2O3固体混合物中Fe2O3的质量,D装置的硬质双通玻璃管中的固体物质是FeO和Fe2O3的混合物。
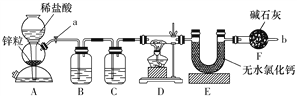
(1)为了安全,在点燃D处的酒精灯之前,在b处必须________________。
(2)装置B的作用是_______________ ,装置C中盛装的液体是________________。
(3)在硬质双通玻璃管中发生的化学反应方程式是________________________________、__________________________。
(4)若为FeO和Fe2O3物质的量之比1∶1的固体混合物,反应完全后,U型管的质量增加7.2 g,则混合物中Fe2O3的质量为______________。
(5)U型管E右边连接干燥管F的目的是________________,若无干燥管F,测得Fe2O3的质量将_____________(填“偏大”“偏小”或“无影响”)。
(6)铁的化合物的固体或溶液中常常混有需要除去的杂质,试对下列物质(括号内为杂质),使用合适的试剂或分离方法除杂。
①Fe2O3[Fe(OH)3]___________________________________;
②FeCl3溶液(FeCl2)___________________________________;
③FeCl2溶液(FeCl3)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
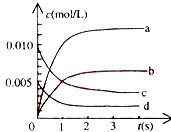
①图中表示NO2变化的曲线是 , 用O2表示从0~2s内该反应的平均速率v= .
②能说明该反应已经达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.Ca(OH)2 ![]() Ca(ClO)2
Ca(ClO)2 ![]() HClO
HClO
B.Fe ![]() Fe2O3
Fe2O3 ![]() FeCl3
FeCl3
C.SO2 ![]() NH4HSO3
NH4HSO3 ![]() (NH4)2SO3
(NH4)2SO3
D.FeS2 ![]() SO3
SO3 ![]() H2SO4
H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平.下图是由乙烯为原料生产某些化工产品的转化关系图. 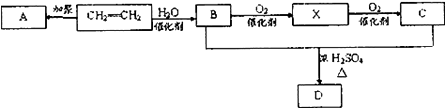
据此回答下列问题.
(1)写出乙烯的一种用途 , 指出乙烯→B的反应类型(选填取代反应或加成反应) .
(2)写出A的结构简式 .
(3)写出X和新制的氢氧化铜悬浊液反应的化学方程式 .
(4)写出B+C→D的化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年世界环境日,我国环保部公布中国主题为“改善环境质量,推动绿色发展”.下列做法与该主题相违背的是( )
A.推广和鼓励多使用公共交通工具出行
B.植树造林,绿化环境
C.利用廉价煤炭,大力发展火力发电
D.对燃煤进行脱硫,减少空气的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaSO4在水中的沉淀溶解平衡曲线,如图所示,向100mL该条件下的CaSO4饱和溶液中,加入400mL 0.01mol/L的Na2SO4溶液,针对此过程的下列叙述正确的是( ) 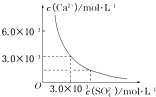
A.溶液中析出CaSO4沉淀,最终溶液中c(SO ![]() )较原来大
)较原来大
B.溶液中无沉淀析出,溶液中c(Ca2+)、c(SO ![]() )都变小
)都变小
C.溶液中析出CaSO4沉淀,溶液中c(Ca2+)、c(SO ![]() )都变小
)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO ![]() )较原来大
)较原来大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )

A. 298K时,HCOOH的电离常数Ka=1.0×10-10.25
B. 0.1mol·L-1HCOONa溶液中有c(HCOO-)+c(HCOOH)+c(OH-)<c(H+)+0.1
C. 298K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH-)增大
D. 0.1mol·L-1HCOONa溶液和0.1mol·L-1HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com