
在元素周期表中,磷元素的某些信息如下图所示。下列说法不正确的是( )
 A.磷元素为非金属元素
A.磷元素为非金属元素
B.磷原子核外有15个电子
C.磷的原子序数为15
D.相对原子质量为30.97g
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.乙烯和聚乙烯都能使溴的四氯化碳溶液褪色
B.淀粉和纤维素都可以作为工业上生产葡萄糖的原料
C.油脂的水解反应,都是皂化反应
D.蔗糖是高分子化合物,其水解产物能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而
且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3 + 4 HCl=2 ClO2↑+ Cl2↑+ 2 NaCl + 2 H2O
方法二:2 NaClO3 + H2O2 + H2SO4=2 ClO2↑+ O2↑+Na2SO4 + 2 H2O
(1)方法一的离子方程式是 。
(2)方法二中被还原的物质是 ,若反应中产生的ClO2气体在标准状况下的体积为2.24L,则电子转移数为 NA。
(3)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:1,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)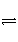
 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=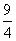 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol·L-1 | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol·L-1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI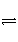
 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
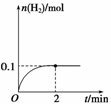
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)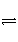
 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)有下列四种微粒:①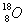 ②
② ③
③ ④
④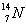 (用序号填空)
(用序号填空)
I.按原子半径由大到小顺序排列是_________________。
II.微粒中质子数小于中子数的是________________。
III.在化合物中呈现的化合价的数值最多的是 ________________。
IV.能形成X2Y2型化合物的是____________,能形成X3Y2型化合物的是____________。
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序是__ ________,原子序数由大到小的顺序是_ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6 L三氧化硫含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
对可逆反应4NH3(g)+5O2(g)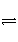
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是2v正(NH3)=3v正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com