

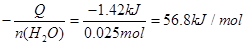 ;热化学方程式为:
;热化学方程式为:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1 2FeO(s) △H3
2FeO(s) △H3| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
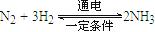 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.白磷在氧气中燃烧的热化学方程式是:P4(s)+5O2(g)=P4O10(s) ΔH=-745.8kJ·mol-1 |
| B.红磷转化成白磷时放出热量 |
| C.31g红磷中蕴含的能量为738.5k |
| D.红磷比白磷稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
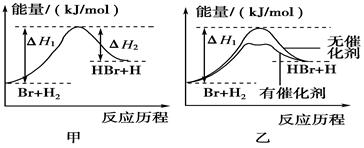
| A.正反应吸热 |
| B.加入催化剂,该化学反应的反应热不变 |
| C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示 |
| D.加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
B.氢气的燃烧热为285.8kJ ·  ,则氢气燃烧的热化学方程式为 ,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ·  |
| C.Ba(OH)2 · 8H2O(s)+2NH4Cl(s)=BaCl2(s)+2NH3(g)+10H2O(l);△H<0 |
| D.某酸溶液可以与石灰石反应放出CO2,则该酸不一定为强酸。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com