
(9��)���¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
|
��ѧ����ʽ |
K (T1 ) |
K (T2) |
|
F2+H2 |
1.8 ��1036 |
1.9 ��1032 |
|
Cl2+H2 |
9.7 ��1012 |
4.2 ��1011 |
|
Br2+H2 |
5.6 ��107 |
9.3 ��106 |
|
I2+H2 |
43 |
34 |
��1��������K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ�_______��ѡ����ĸ��
a. ����ͬ�����£�X2��ƽ��ת�������� b. X2��H2��Ӧ�ľ��ҳ̶�����
c. HX���ȶ������� d. HX�Ļ�ԭ����
��2�����ݻ�Ϊ3L���ܱ������У���I2(g)��H2(g)�ϳ�HI(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬HI�����ʵ����ı仯�������ͼ��ʾ��
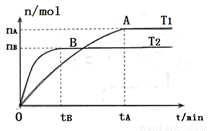
���¶�ΪT1ʱ����0~tAmin�ڣ�H2����������v (H2)=__________
�ڷ�����ͼ��ʾͼ������˵����ȷ����________������ţ�
a���¶�ΪT2�������������ܶȲ���ʱ����Ӧ����B����ʾ״̬
b��ƽ��״̬��A���ƶ���B�㣬n(HI)/n(H2)����
c���÷�ӦΪ���ȷ�Ӧ
(3)��ˮϡ��0.1mol��L-1��HF��Һ�����и������������________������ţ�
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
��4����0.1mol��L-1HCl��Һ�м������AgNO3��Һ��������ɫ�������ٵμ�KI��Һ�����ֻ�ɫ��������д���йص����ӷ���ʽ �� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶� | ��ʼ�¶�t1/�� | ��ֹ�¶� t1/�� |
�¶Ȳ� ��t2-t1��t1/�� | ||
| ʵ����� | H2SO4 | NaOH | ƽ��ֵ | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| C(H2)C(CO) |
| C(H2O) |
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 ����֪N-N������Ϊ167kJ?mol-1��NO2�е������ļ���Ϊ466kJ?mol-1��N2O4�е������ļ���Ϊ438.5kJ?mol-1����д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ
����֪N-N������Ϊ167kJ?mol-1��NO2�е������ļ���Ϊ466kJ?mol-1��N2O4�е������ļ���Ϊ438.5kJ?mol-1����д��NO2ת��ΪN2O4���Ȼ�ѧ����ʽΪ�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(9��)���¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
| ��ѧ����ʽ | K (T1 ) | K (T2) |
| F2+H2 | 1.8 ��1036 | 1.9 ��1032 |
| Cl2+H2 | 9.7 ��1012 | 4.2 ��1011 |
| Br2+H2 | 5.6 ��107 | 9.3 ��106 |
| I2+H2 | 43 | 34 |
��1��������K�ı仯�������ƶϳ�������±��ԭ�Ӻ˵���������ӣ�_______��ѡ����ĸ��
a. ����ͬ�����£�X2��ƽ��ת�������� b. X2��H2��Ӧ�ľ��ҳ̶�����
c. HX���ȶ������� d. HX�Ļ�ԭ����
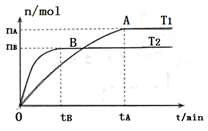
��2�����ݻ�Ϊ3L���ܱ������У���I2(g)��H2(g)�ϳ�HI(g)���������������������£��о��¶ȶԷ�Ӧ��Ӱ�죬HI�����ʵ����ı仯�������ͼ��ʾ��
���¶�ΪT1ʱ����0~tAmin�ڣ�H2����������v (H2)=__________
�ڷ�����ͼ��ʾͼ������˵����ȷ����________������ţ�
a���¶�ΪT2�������������ܶȲ���ʱ����Ӧ����B����ʾ״̬
b��ƽ��״̬��A���ƶ���B�㣬n(HI)/n(H2)����
c���÷�ӦΪ���ȷ�Ӧ
(3)��ˮϡ��0.1mol��L-1��HF��Һ�����и������������________������ţ�
a.c(H+) b. Ka(HF) c. c(F-)/c(H+) d. c(H+) / c(HF)
��4����0.1mol��L-1HCl��Һ�м������AgNO3��Һ��������ɫ�������ٵμ�KI��Һ�����ֻ�ɫ��������д���йص����ӷ���ʽ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ɽ��ʡ�����и���12���¿���ѧ�Ծ� ���ͣ������
(9��)���¶�T1��T2�£�X2(g)�� H2��Ӧ����HX��ƽ�ⳣ�����±���
| ��ѧ����ʽ | K (T1 ) | K (T2) |
F2+H2  2HF 2HF | 1.8 �� 1036 1036 | 1.9 ��1032 |
Cl2+H2  2HCl 2HCl | 9.7 ��1012 | 4.2 ��1011 |
Br2+H2  2HBr 2HBr | 5.6 ��107 | 9.3 ��106 |
I2+H2  2HI 2HI | 43 | 34 |
 ̬
̬�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com