
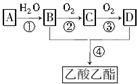
 已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:
已知:①A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2$→_{△}^{催化剂}$2CH3COOH.现以A为主要原料合成乙酸乙酯,其合成路线如下:分析 A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到乙酸乙酯,据此解答.
解答 解:A是石油裂解气的主要成分,是一种相对分子质量为28的气态烃,A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,B能氧化得到C为CH3CHO,C氧化得到D为CH3COOH,乙醇与乙酸发生酯化反应得到乙酸乙酯,
(1)A的结构简式为CH2=CH2,故答案为:CH2=CH2;
(2)B为CH3CH2OH,D为CH3COOH,B、D分子中的官能团名称分别是羟基、羧基,
故答案为:羟基;羧基;
(3)物质A可以被直接氧化为D,其化学方程式可表示为CH2=CH2+O2$\stackrel{一定条件下}{→}$CH3COOH,
故答案为:CH2=CH2+O2$\stackrel{一定条件下}{→}$CH3COOH;
(4)①CH2=CH2与水发生加成反应生成CH3CH2OH,化学方程式为:CH2=CH2+H2O $\stackrel{一定条件下}{→}$CH3CH2OH,该反应是加成反应,
④CH3COOH与CH3CH2OH在浓硫酸作用下加热发生酯化反应生成CH3COOCH2CH3,该反应为酯化反应或取代反应,反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O $\stackrel{一定条件下}{→}$CH3CH2OH;加成反应;CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应或取代反应.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确官能团及其性质关系、物质之间的转化是解本题关键,熟练掌握常见反应类型及有机物性质,题目难度不大.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
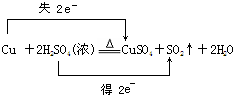 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(X2)=0.1mol•L-1 | B. | c(Y2)=0.3mol•L-1 | C. | c(X2)=0.2mol•L-1 | D. | c(Z)=0.3mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeI2溶液中加入少量氯水2Fe2++Cl2=2Fe3++2Cl- | |
| B. | NaClO (aq) 中通入过量 SO2:C1O-+SO2+H2O=HClO+HSO3- | |
| C. | 氯气通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| D. | 次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2 HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 分液时,上层液体从分液漏斗下口流出 | |
| C. | 在制取蒸馏水的实验中收集冷凝水时,应弃去开始蒸馏出的部分 | |
| D. | 在制取蒸馏水的实验中,冷水从冷凝管上口入,下口出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
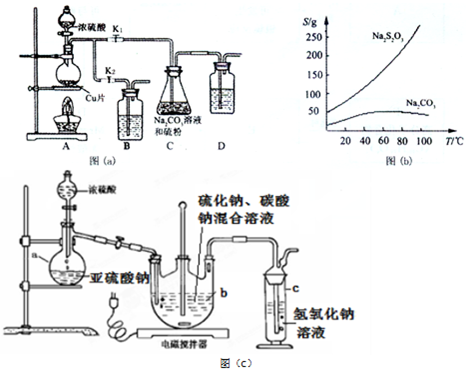
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com