
X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:填空题
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)砷的基态原子的电子排布式为 。
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主。Ga和As相比,电负性较大的是 ,GaAs中Ga的化合价为 。
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;
AsH3的沸点高于PH3,其主要原因为 。
(4)Na3AsO4可作杀虫剂。AsO43-的立体构型为 ,与其互为等电子体的分子的化学式为 (任写一种)。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图。已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为______g/cm3(只要求列算式,不必计算)。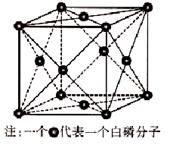
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)
短周期元素X、Y、Z、W在周期表中的位置如图所示,其中W的氧化物是酸雨形成的主要物质。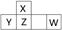
(1) 写出W的原子结构示意图: 。
(2) 将足量X的最高价氧化物通入含Y元素的阴离子溶液中。反应的离子方程式为 。
(3) 已知:①X(s) + O2(g) =XO2(g) ΔH=-393.5 kJ·mol-1
②H2(g) + 1/2 O2(g) =H2O(g) ΔH=-242.0 kJ·mol-1
③XH4(g) + 2O2(g) =XO2(g) + 2H2O(g) ΔH=-802.0 kJ·mol-1
则XH4气体分解成氢气和X固体的热化学方程式为 。
(4) ZO是由单质X和ZO2反应制取单质Z的中间产物。隔绝空气时,ZO与NaOH溶液反应(产物含有一种固体单质和一种钠盐)的化学方程式为_______________。
(5) 利用原电池原理,可用W的一种氧化物、O2和H2O来制备W的最高价氧化物对应水化物。写出该电池负极反应式:___________。
(6) 将W的气态氢化物通入一定量的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,生成气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)。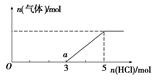
①O点溶液中所含溶质的化学式为____________。
②a点溶液中,c(Na+): c(Cl-)= _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________,属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。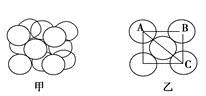
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
今有甲、乙、丙、丁四种元素。已知:甲元素是自然界中含量最多的元素;乙元素为金属元素,它的原子核外K层、L层电子数之和等于M、N层电子数之和;丙元素的单质及其化合物的焰色反应都显黄色;氢气在丁元素单质中燃烧火焰呈苍白色。
(1)试推断并写出甲、乙、丙、丁四种元素的名称和符号;
(2)写出几种上述元素两两化合形成的化合物的化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: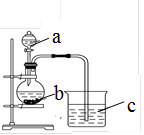
(1)仪器a的名称是 ,应盛放下列药品中的 (填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的 (填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为 。
若看到仪器C中的现象是 ,即可证明 比 酸性强(填化学式),得电子的能力 比 强。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com