
下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是( )
| A.增大反应物的浓度,活化分子百分数增加,反应速率加快? |
| B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快 |
| C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大 |
| D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大 |
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
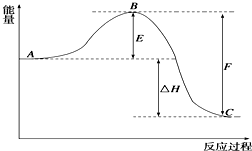 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H1=-99kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与CO2 | B、Ca(OH)2与CO2 | C、Na与O2 | D、C与O2 |
查看答案和解析>>
科目:高中化学 来源:2014届河南安阳一中高二月考(奥数班)化学试卷(解析版) 题型:选择题
下列对“改变反应条件,导致化学反应速率改变”的原因描述不正确的是( )
A.增大反应物的浓度,活化分子百分数增加,反应速率加快?
B.增大气体反应体系的压强,单位体积中活化分子数增多,气体反应速率加快
C.升高反应的温度,活化分子百分数增加,有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应所需的活化能降低,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com