
����ѧ����ѡ��2��ѧ�뼼�������Ṥҵ�ڹ�����ռ�м�����Ҫ�ĵ�λ��
��1����ҵ������ʱ�������������Ҫ�ɷ�ΪFeS2��������Ԫ�صĻ�����Ϊ ��
��2�������������������ǻ��ʹ�ҵ������������ij��������� (��дһ��)��
��3�����������У����ݻ�ѧƽ��ԭ����ȷ�����������ʩ�� (��д���)��
A����ʯ�������¯֮ǰ�ȷ��� B��ʹ��V2O5������
C��ת������ʹ�����˵��¶� D���������¯����Ҫ�й����Ŀ���
E���������ڳ�ѹ�½��� F������������98.3%��Ũ��������SO3
��4�������Ṥҵ�У�ͨ�����з�Ӧʹ��������ת��Ϊ��������
2SO2(g)��O2(g) 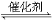 2SO3(g)�� ��H����98.3 kJ��mol��1
2SO3(g)�� ��H����98.3 kJ��mol��1
��ʵ�ʹ�ҵ�����У������á���ת����������������һ��ת�����ɵ�SO2�����δת����SO2���ж���ת������������SO2��ת���ʾ�Ϊ95%��������SO2��ת����Ϊ ��
��5������Ĺ�ҵ�Ʒ������漰������Ҫ�Ļ�ѧ��Ӧ����Ӧ���豸(����¯��ת������������))��
�������豸�ֱ�ʹ��Ӧ��֮����������������ˡ�����������������������з�Ӧ��֮�������������ġ�
____________________________________________________________________��
�ڹ�ҵ�����г��ð����ᷨ����β�������Դﵽ������Ⱦ���������õ�Ŀ�ġ��û�ѧ����ʽ��ʾ�䷴Ӧԭ����(ֻд��2������ʽ����)
______________________________________________________________________
_____________________________________________________________________��
��6��ʵ���ҿ��������᳧¯��(��Ҫ�ɷ�Ϊ���������P����FeS��SiO2��)�Ʊ��������̷�(FeSO4•7H2O)�������Ļ�ѧʽΪ[Fe2(OH)n(SO4)3��0.5n]m���Ʊ�������ͼ��ʾ������˵����ȷ���� ��
A��¯����FeS������������ķ�Ӧ�����ӷ���ʽΪ��4FeS+3O2+12H+�T4Fe3++4S��+6H2O
B������M�ijɷ���SO2��ͨ��˫��ˮ�õ����ᣬ��ѭ��ʹ��
C������ҺX�м���������ۣ���ַ�Ӧ����˵õ���ҺY���ٽ���ҺY�����ᾧ���ɵõ��̷�
D����ҺZ��pHӰ�������������������������pHƫС�������¾�����������������ƫ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڿ�ǰ��ϰ��ѧ�Ծ��������棩 ���ͣ�ʵ����
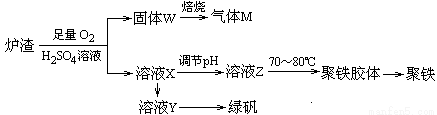
�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ����������£�
��֪��CuFeS2 + 3CuCl2��4CuCl�� + FeCl2 + 2S��
��1����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ ��
��2��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ ��
��3��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽��������� ��(�����ӷ���)
��4������3������Һ�п���ѭ��ʹ�õ������� ��Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ ��
��5��ұ�����ջ����Խ���ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ����ѧ����ʽΪ��6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2 Cu2S+O2
3Cu2S+2Fe3O4+9SO2 Cu2S+O2 2Cu+SO2
2Cu+SO2
�˹�����ǰһ���������Ҫȱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڵ绯ѧ������˵����ȷ����
A����ҵ���õ��MgCl2��Һ�ķ���ұ��Mg
B����������������ʴ��������ӦʽΪ4OH��-4e���TO2��+2H2O
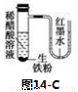
C����ͼ14-C�з�����Ӧ�ķ���ʽΪ��Fe��2H��=Fe2����H2��
D������п�̸ɵ�طŵ�ʱ��������ӦΪ�� MnO2��H2O��e����MnOOH��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʯ��ɽ���и�������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��������(ClO2)�ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ���������(NaClO3)����������(NaClO2)Ϊԭ���Ʊ�ClO2��
��1����������Ҳ��һ������������Ư��������ǿ������Һ�лᷢ���绯��Ӧ������ClO2���壬���ӷ���ʽΪ___________________________��������������Һ�м������ᣬ��Ӧ���ҡ����������Ϊ��ͬpH�����ᣬ��ʼʱ��Ӧ�������Ժ�һ��ʱ�������������Ѹ�ټӿ졣������������Ѹ�ټӿ��ԭ���� ��
��2����ѧ���ɲ��������˫��ˮ��ԭ�������Ʊ�ClO2����H2O2����ԭ���Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ���� ��
��3����ⷨ��Ŀǰ�о���Ϊ���ŵ�����ClO2�ķ���֮һ����ͼ��ʾΪֱ�ӵ�������ơ��Զ���ѭ���Ʊ��ߴ�ClO2��ʵ�顣
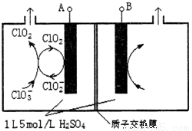
�ٵ�Դ����Ϊ___________________��(��A��B)
��д�������ҷ�����Ӧ�ĵ缫��Ӧʽ�����ӷ���ʽ
_______________________ ___ �� ��
�ۿ��Ƶ��ҺH+������5mol/L������Ч��ֹ��H+Ũ�Ƚ��Ͷ����µ�ClO2���绯��Ӧ�����������ռ�������22.4L(���������Ϊ��״�������Ե��Һ����ı仯��ClO2�����ܽ�IJ���)����ʱ��������������c(H+)֮��Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʯ��ɽ���и�������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��R��T��X��Y��Z��Ԫ�����ڱ������λ�����±���ʾ�����ǵ�����������
֮��Ϊ24���������ж���ȷ����
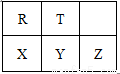
A����̬�⻯���ȶ��ԣ�Y��T
B��R�ֱܷ���X��Z�γɹ��ۻ�����
C��Rλ��Ԫ�����ڱ��еڶ����ڵ�VA��
D��ZԪ�ص�����������Ӧ��ˮ����Ļ�ѧʽΪHZO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ���������һ��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������У���ˮ�ĵ���ƽ�ⲻ����Ӱ�����
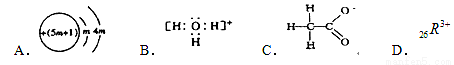
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�������ߴ�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
[��ѧ��ѡ��3�����ʽṹ������]
��1�������й�������������˵����ȷ����
A����λ����ǿ���д���С�������е��������ȶ����еĺܲ��ȶ�
B��ˮ���ȵ��ܸߵ��¶ȶ����Էֽ�����Ϊˮ���Ӽ�������
C���ڻ����ڹ⻬��ǽ������������Ϊ�ڻ��ŵ�ϸë���������ķ��Ӳ������Ӽ�������
D����Ϊ�����칹���ķ��Ӿ�����ȫ��ͬ����ɺ�ԭ�����У�������������ҩ��ʱ������������칹��
��2���ж������ĸ�ģ�ʹ�����������п�Ķѻ���ʽ ��

��3����������δ�ɶԵ���������P��Ԫ�ص�Ԫ�ط����� ���������ռ��
��ԭ�ӹ����
��4��̼������ϩ��������ӵ�ص��µ��Һ����Ҫ���Ӽ�����ṹ��ͼ��̼ԭ�ӵ��ӻ���ʽ�� �������ЦҼ���м�֮��Ϊ ��
��5���Ƚ�NH2����NH3�ļ��ǡ�HNH�Ĵ�С��NH2�� NH3���������=���������������ü۲���ӶԻ������ͣ� ��
��6��SO32������ԭ�ӵļ۲���ӶԻ���ģ���� ��д��һ����SO32����Ϊ�ȵ�����ķ��� ��
��7��SiC��������ʯ�������ƣ��辧���߳�Ϊa cm��̼ԭ��ֱ��Ϊb cm����ԭ��ֱ��Ϊc cm����þ����Ŀռ�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ������ѧ�ڳ��ģ�����ۻ�ѧA���������棩 ���ͣ�ʵ����
�������ƣ�NaClO2������ҪƯ����ij��ѧ��ȤС��ͬѧչ�����������ƣ�NaClO2�����о���
ʵ�����ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2•3H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��Ba(ClO2)2������ˮ��
������ͼ��ʾװ�ý���ʵ�顣
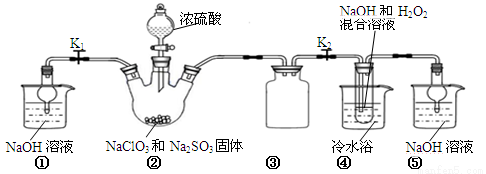
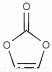
��1��װ�â��в���ClO2����Ļ�ѧ����ʽΪ ��
��2����װ�âܷ�Ӧ�����Һ��þ���NaClO2�IJ�������Ϊ��
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ��� ���ܵ���60�����õ���Ʒ�������õ��IJ��������� ��
��3�����ʵ���������NaClO2�����Ƿ�������Na2SO4�������ǣ� ��
��4����Ӧ�����ر�K2����K1��װ�âٵ������� �������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е������� ��
ʵ��ⶨij����������Ʒ�Ĵ��ȡ�
�������ʵ�鷽����������ʵ�飺
��ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ����֪��ClO2��+ 4I��+4H+ =2H2O+2I2+Cl�����������û��Һ���100mL������Һ��
����ȡ25.00mL������Һ����ƿ�У���c mol•L-1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ�������ı���Һ�������ƽ��ֵΪV mL����֪��I2 +2S2O32��=2I��+S4O62������
��5���ζ���ʹ�õ�ָʾ���� ���ﵽ�ζ��յ�ʱ������Ϊ ��
��6����Ʒ��NaClO2����������Ϊ ���ú�m��c��V�Ĵ���ʽ��ʾ��ʽ����NaClO2 90.5����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016���㽭ʡ����5�¸߿�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A�����ܽ��Ƕ�ʮһ���͵���Ҫ��Դ���ƹ�Ӧ��������ؼ������Ǹ�����������ϵ�����
B������TiO2�ⴥý�����Ƴɵġ�ľ�ذ徫�͡��ܽ�ˮ��ת��Ϊ���������ɴ˿��Ʋ�TiO2�ⴥý�����Ƴɵġ�ľ�ذ徫�Ϳ�����Ч�����ȩ���������Ⱦ�����Ⱦ��
C���ߴ��ȵĶ�������㷺�����������ά�����ά��ǿ�ᡢǿ��ᡰ��·��
D���Ž��з������Ԫ��������Ϊ������Ԫ�ء��ϳ��²����ṩ����˼·
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com